Lösungen zu den Teste-dich-Aufgaben
a Ethanol
b Alkoholische Gärung
c Traubenzucker → Ethanol + Kohlenstoffdioxid
d Man kann das Gas Kohlenstoffdioxid nachweisen, indem man es in Kalkwasser leitet. Wenn Kohlenstoffdioxid vorhanden ist, trübt sich das Kalkwasser und wird milchig.
a Ethanol ist als Lösungsmittel vielseitig einsetzbar, weil es sowohl hydrophile als auch lipophile Substanzen lösen kann. Dies liegt an seiner Molekülstruktur, die eine polare Hydroxylgruppe enthält, die Wasserstoffbrückenbindungen mit Wasser eingehen kann, und einem Ethylrest, der unpolare Verbindungen lösen kann.
b Das GHS-Symbol weist darauf hin, dass Ethanol leicht entzündbar ist. Eine Anwendungsmöglichkeit, die sich daraus ergibt, ist die Verwendung von Ethanol als Brennstoff, beispielsweise in Spiritus.
c Ethanol ist leicht entzündbar, daher muss beim Experimentieren darauf geachtet werden, dass keine offenen Flammen oder Funken in der Nähe sind. Zudem sollten Experimente mit Ethanol in gut belüfteten Räumen durchgeführt werden, um die Bildung entzündlicher Dämpfe zu vermeiden.
a
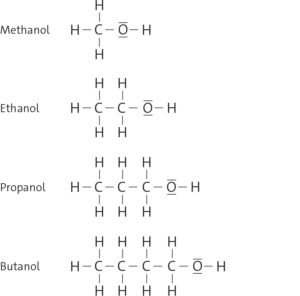
b Die Alkohole bilden eine homologe Reihe, weil sich jedes aufeinanderfolgende Mitglied vom vorherigen durch eine CH2-Gruppe unterscheidet. Man kann eine allgemeine Summenformel aufstellen: CnH2n+1OH.
c Die Viskosität der Alkanole nimmt innerhalb der homologen Reihe mit zunehmender Länge der Kohlenwasserstoffkette zu. Dies liegt daran, dass die Van-der-Waals-Kräfte zwischen den längeren Kohlenwasserstoffketten stärker werden, was zu einer höheren Zähflüssigkeit führt.
a Methanol löst sich gut in Wasser, aber nicht in Hexan.
b Methanol ist aufgrund seiner Hydroxylgruppe ein polares Molekül und kann Wasserstoffbrückenbindungen mit Wasser eingehen, was zu einer guten Löslichkeit in Wasser führt. Hexan hingegen ist ein unpolares Lösungsmittel. Da Methanol polar ist, löst es sich nicht gut in Hexan.
a Methan hat eine Siedetemperatur von –161 °C, während Methanol eine deutlich höhere Siedetemperatur von 65 °C hat.
b Der Unterschied in den Siedetemperaturen kommt durch die unterschiedlichen zwischenmolekularen Anziehungskräfte zustande. Methan ist ein unpolares Molekül und weist nur schwache Van-der-Waals-Kräfte auf. Methanol hingegen hat eine polare Hydroxyl-Gruppe, die Wasserstoffbrückenbindungen ermöglicht. Diese Wasserstoffbrückenbindungen sind viel stärker als die Van-der-Waals-Kräfte. Das führt zu einer höheren Siedetemperatur, da mehr Energie benötigt wird, um die Moleküle voneinander zu trennen.
a A) Ethanol, B) Essigsäure, C) Citronensäure
b Wenn man Wein längere Zeit offen stehen lässt, dann wird er sauer und zu Essig. Dieser Prozess wird durch Essigsäurebakterien verursacht, die in Gegenwart von Sauerstoff Ethanol zu Essigsäure oxidieren. Diese Stoffumwandlung nennt man Essigsäuregärung.
c Essig im Gurkenglas dient als Konservierungsmittel, um die Gurken länger haltbar zu machen und verleiht ihnen gleichzeitig die typische Würze.
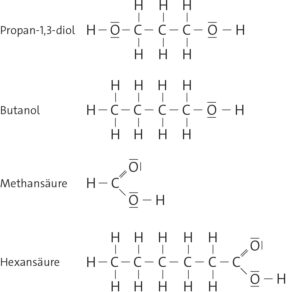
a Eine Carbonsäure besteht aus einer Carboxyl-Gruppe (-COOH) und einem Alkylrest. Ein Beispiel ist die Essigsäure die aus der Carboxy-Gruppe und einem Ethylrest besteht.
b Für die saure Reaktion von Carbonsäuren wie Essigsäure ist die Carboxyl-Gruppe verantwortlich. In einer wässrigen Lösung zerfallen die Moleküle in ein Wasserstoff-Ion und ein Säurerest-Ion:
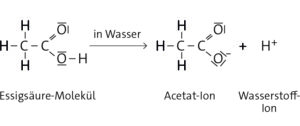
Die Wasserstoff-Ionen sind für die sauren Eigenschaften verantwortlich.
c Die Essigsäure ist stärker sauer als die Buttersäure. Dies liegt daran, dass mit zunehmender Kettenlänge der Einfluss der Carboxyl-Gruppe abnimmt, was zu einer geringeren Säurestärke führt.
a A) Alkohole oder Alkanole, Carbonsäuren oder Alkansäuren
b Die Verbindung A besitzt eine Hydroxy-Gruppe, was die funktionelle Gruppe der Alkohole ist.
Die Verbindung B besitzt eine Carboxyl-Gruppe, was die funktionelle Gruppe der Carbonsäuren ist.
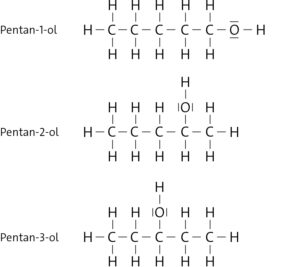
c A) Hexan-1-ol; B) Propansäure
d Es gibt drei Isomere: Hexan-1-ol, Hexan-2-ol, Hexan-3-ol.