Lösungen zu den Teste-dich-Aufgaben
a Bei einer Elektrolyse wird eine chemische Verbindung zerlegt. Es ist eine durch elektrische Energie erzwungene Redoxreaktion.
b Die Chlorid-Ionen wandern zum Pluspol und geben jeweils ihr Außenelektron ab. Dabei werden die Chlorid-Ionen zu Chloratomen oxidiert. Die Silber-Ionen wandern zum Minuspol und nehmen jeweils ein Elektron auf. Dabei die Silber-Ionen zu Silberatomen reduziert.
c Pluspol: Cl– → Cl + e–
Minuspol: Ag+ + e– → Ag
d Die Elektrolyse wird beim Galvanisieren genutzt. Dabei wird ein metallischer Gegenstand mit einer dünnen Schicht eines anderen Metalls überzogen. Eisenschrauben werden auf diese Weise zum Beispiel mit Zink überzogen, damit das Eisen vor Korrosion geschützt ist.
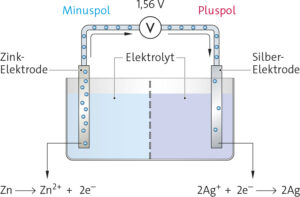
a Die chemische Energie, die in einer galvanischen Zelle gespeichert ist, wird beim Betrieb in elektrische Energie umgewandelt.
b In einer galvanischen Zelle tauchen zwei Elektroden aus unterschiedlichen Stoffen in einen Elektrolyten.
c Im Betrieb einer galvanischen Zelle findet ein Elektronenübergang statt. Die Atome des unedleren Metalls geben Elektronen an die Ionen des edleren Metalls ab. Wenn die galvanische Zelle zum Beispiel aus einer Zink- und einer Kupfer-Elektrode besteht, dann übertragen die unedleren Zinkatome jeweils zwei Elektronen auf die Kupfer-Ionen.
a Akkus können im Gegensatz zu Primärbatterien wieder aufgeladen werden.
b Primärbatterie: Alkalinebatterie; Akku: Lithium-Ionen-Akku
c Laden: elektrische Energie → chemische Energie; Entladen: chemische Energie → elektrische Energie
d Primärbatterie eignen sich für Geräte, die wie Taschenlampen selten benutzt werden oder für Geräte wie Uhren, die über einen längeren Zeitraum eine konstante Spannung benötigen. Akkus eignen sich für Geräte, die in kurzer Zeit viel Energie benötigen und häufig in Gebrauch unter anderem für Smartphones und Notebooks.
a/ b/ c
a Batterien und Akkus müssen in speziellen Sammelbehältern entsorgt werden.
b Sie dürfen nicht in den Hausmüll gegeben werden, denn so würden die umweltgefährliche Stoffe, die in Batterien enthalten sind, in die Umwelt gelangen .Durch die Abgabe in den Sammelbehältern wird zudem sichergestellt, dass die enthaltenen Wertstoffe recycelt werden.
c Beispiele: Nickel für die Stahlherstellung, Zink für das Verzinken von Eisengegenstände
a Bei der Verbrennung von Wasserstoff entsteht nur Wasser, ein ungefährliches Reaktionsprodukt.
b 2 H2 + O2 → 2 H2O
c Bei der Gewinnung von Wasserstoff bei der Elektrolyse von Wasser wird elektrische in chemische Energie umgewandelt:
Bei der Verbrennung von Wasserstoff in einer Brennstoffzelle wird die chemische Energie wieder in elektrische Energie umgewandelt:
d Eine Wasserstoff-Brennstoffzelle besteht aus zwei Elektroden, die in einen Elektrolyten eintauchen und über einen elektrischen Leiter verbunden sind. Wasserstoff wird am Minuspol durch einen Platinkatalysator in Wasserstoffionen (H⁺) und Elektronen (e⁻) gespalten. Die Elektronen fließen über den elektrischen Leiter zum Pluspol, wo Sauerstoffmoleküle durch den Platinkatalysator gespalten werden und mit den Elektronen zu O₂⁻-Ionen reagieren. Die H⁺-Ionen wandern durch den Elektrolyten und verbinden sich an der Sauerstoffelektrode mit den O₂⁻-Ionen zu Wassermolekülen.