Lösungen zu den Teste-dich-Aufgaben
a Kochsalz reguliert den Wasserhaushalt der Zellen und den Blutdruck. Es ermöglicht die Reizleitung in den Nervenzellen und wird für die Produktion der Magensäure benötigt.
b Das Meerwasser wird in große, flache Becken geleitet. Man nennt diese Vorrichtung Saline. Wenn das Wasser mit der Zeit verdunstet, kristallisiert das Salz langsam zu einer weißen Kruste. Das Salz wird zwischen den Becken gesammelt, um es zu trocknen. Danach wird das verunreinigte Rohsalz gewaschen, wieder getrocknet, erneut kristallisiert und fein vermahlen.
a Ionen
b Kationen → positiv geladen; Anionen → negativ geladen
c Im Experiment wird beobachtet, dass der Kochsalzkristall den elektrischen Strom nicht leitet. Die Kochsalz-Lösung hingegen leitet den elektrischen Strom.
d Der Kochsalzkristall leitet den elektrischen Strom nicht, da die Ionen im Kristallgitter fest gebunden und unbeweglich sind. In der wässrigen Kochsalz-Lösung hingegen sind die Ionen im Wasser gelöst und somit frei beweglich.
e Elektrolyt
a 2 Na + Cl2 → 2 NaCl
b Die besondere Reaktionsfreudigkeit der Halogene lässt sich durch ihre Stellung in der siebten Hauptgruppe des Periodensystems erklären. Halogene haben sieben Außenelektronen und es fehlt ihnen nur ein Elektron, um den stabilen Edelgaszustand mit einer voll besetzten Außenschale zu erreichen. Das macht sie sehr reaktionsfreudig.
c Alkalimetalle haben in ihrer Außenschale nur ein Elektron, das sie leicht abgeben können, um den stabilen Edelgaszustand zu erreichen. Halogene hingegen haben sieben Außenelektronen und benötigen nur ein weiteres Elektron, um ebenfalls den Edelgaszustand zu erreichen. Durch die Elektronenübertragung von Alkalimetallen zu Halogenen können beide Elemente den stabilen Edelgaszustand erreichen, was die Reaktionsfreudigkeit zwischen ihnen erklärt.
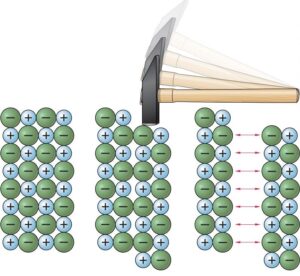
a Salze bestehen aus positiv und negativ geladenen Ionen, die sich in einem dreidimensionalen Ionengitter anordnen. In diesem Gitter sind die Ionen auf festen Gitterplätzen gebunden. Die Anziehungskräfte zwischen den entgegengesetzt geladenen Ionen wirken in alle Raumrichtungen, was zu einer stabilen und regelmäßigen Struktur führt.
b Salze sind besonders hart, weil ihre entgegengesetzt geladenen Ionen durch starke Anziehungskräfte fest an ihren Gitterplätzen gebunden sind.
c Im Ionengitter sind positive und negative Ionen abwechselnd angeordnet. Bei großer Krafteinwirkung verschieben sich die Schichten der Ionen gegeneinander, wodurch gleichsinnige Ladungen nebeneinander zu liegen kommen. Diese gleichsinnigen Ladungen stoßen sich ab, was dazu führt, dass der Kristall auseinanderbricht.
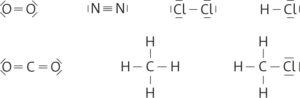
a Elektronenpaarbindung
b
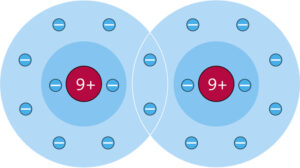
c Eine unpolare Elektronenpaarbindung liegt vor, wenn die bindenden Elektronenpaare gleichmäßig zwischen den Atomen verteilt sind, wie im Chlor-Molekül (Cl₂). Beide Chloratome haben die gleiche Elektronegativität, daher ziehen sie die bindenden Elektronenpaare gleich stark an.
Eine polare Elektronenpaarbindung liegt vor, wenn die bindenden Elektronenpaare zu einem der beteiligten Atome verschoben sind, wie im Chlorwasserstoff-Molekül (HCl). Das Chloratom hat eine höhere Elektronegativität als das Wasserstoffatom und zieht die bindenden Elektronenpaare stärker an, wodurch eine ungleiche Verteilung der Elektronen entsteht.
d
a Ein Wasser-Molekül besteht aus einem Sauerstoffatom und zwei Wasserstoffatomen, die jeweils durch eine polare Elektronenpaarbindungen miteinander verbunden sind. Das bindende Elektronenpaar ist jeweils zum Sauerstoffatom hin verschoben. Das Wasser-Molekül hat eine gewinkelte Struktur.
b Das Wasser-Molekül ist ein Dipol, weil es zwei Pole besitzt: Das Sauerstoffatom besitzt eine negative Teilladung (δ–) und die Wasserstoffatome besitzen positive Teilladungen (δ+). In der Nähe des elektrisch geladenen Kunststoffstabs richten sich die Dipolmoleküle so aus, dass sich ungleichnamige Ladungen gegenüberliegen. Da sich ungleichnamige Ladungen anziehen, wird der Wasserstrahl abgelenkt.
c Dichteanomalie: Im flüssigen Zustand liegen die Wasser-Moleküle unregelmäßig und dicht nebeneinander. Beim Gefrieren bilden die Wasser-Moleküle aufgrund der Wasserstoffbrückenbindungen ein regelmäßiges Gitter mit großen Hohlräumen. Dadurch nimmt ein Kilogramm Eis ein größeres Volumen ein als ein Kilogramm flüssiges Wasser, was dazu führt, dass Eis eine geringere Dichte hat und auf Wasser schwimmt.
Oberflächenspannung: Die Wasserstoffbrückenbindungen zwischen den Wasser-Molekülen sorgen dafür, dass die Moleküle fest zusammengehalten werden. Dies führt zu einer hohen Oberflächenspannung, die es Insekten wie dem Wasserläufer ermöglicht, auf der Wasseroberfläche zu laufen, als hätte das Wasser eine Haut.
d Nach und nach schieben sich die polaren Wasser-Dipole zwischen die geladenen Ionen und lösen sie aus dem Ionengitter heraus. Die Wasser-Moleküle lagern sich dabei um die Ionen an und bilden eine Hydrathülle aus. Dabei werden die negativ geladenen Ionen des Salzes so von den Wasser-Molekülen umlagert, dass sich die positiv geladenen Wasserstoffatome zu ihnen orientieren. Bei der Hydrathülle der positiv geladenen Ionen zeigen die negativ geladenen Sauerstoffatome der Wasser-Moleküle zu den Ionen.
a Moleküle: Sauerstoff, Wasser
Atom: Neon
Ionen: Kupferchlorid, Calciumfluorid
b Moleküle: Chlor, Wasserstoff
Atome: Helium, Argon
Ionen: Natriumchlorid, Calciumchlorid