Lösungen zu den Teste-dich-Aufgaben
a Die Masse von Atomen wird in der Atommasseneinheit u angegeben. 1 u entspricht etwa der Masse eines Wasserstoffatoms, also \(1{,}661 \cdot 10^{-24}\) g.
b Die Atommasse eines Kohlenstoffatoms (12 u) ist zwölfmal so groß wie die von Wasserstoff (1 u).
c Die Atommasse wird in der Chemie in u und nicht in Gramm angegeben, weil die Masse der Atome unvorstellbar klein ist. In Gramm wären die extrem kleinen Zahlenwerte unhandlich. Mit der Einheit u kann man Atommassen viel leichter darstellen und vergleichen.
a Das Ergebnis hätte wie in Bild A aussehen können. Weil die meisten α-Teilchen die Goldfolie ungehindert durchdringen, sind besonders viele Lichtblitze in der Mitte des Schirms sichtbar. Weil ein paar der α-Teilchen zurückprallen oder abgelenkt werden, sind ein paar Lichtblitze an den Enden des Schirms sichtbar.
b Der Streuversuch von Rutherford zeigte, dass die meisten α-Teilchen die Goldfolie fast ungehindert durchdrangen, was darauf hinweist, dass Atome größtenteils aus leerem Raum bestehen. Einige α-Teilchen wurden jedoch abgelenkt oder zurückgeworfen, was darauf hinweist, dass es im Inneren des Atoms ein kleines, dichtes und positiv geladenes Zentrum gibt, den Atomkern.
c Laut dem Kern-Hülle-Modell bestehen Atome aus einem kleinen, massiven, positiv geladenen Atomkern, der von einer viel größeren, fast leeren Atomhülle umgeben ist, in der sich die negativ geladenen Elektronen befinden.
a
| Elementarteilchen | Elektron | Proton | Neutron |
| Ort im Atom | Atomhülle | Atomkern | Atomkern |
| Ladung | negativ | positiv | neutral |
| Masse in u | 0,000 55 | 1 | 1 |
b Protonen und Neutronen
c Die Anzahl an positiv geladenen Protonen im Kern entspricht der Anzahl der negativ geladenen Elektronen in der Hülle. Deshalb ist ein Atom nach außen hin elektrisch neutral.
d Isotope eines Elements haben die gleiche Protonenanzahl, sie unterscheiden sich aber in der Anzahl der Neutronen und damit in der Massenzahl.
a Das Atommodell von Dalton besagt, dass alle Stoffe aus kleinsten, unteilbaren, kugelförmigen Teilchen aufgebaut sind, den Atomen. Die Atome eines Elements haben die gleiche Größe und Masse, während sich Atome verschiedener Elemente durch ihre Massen und Größen unterscheiden. Bei chemischen Reaktionen ordnen sich die Atome der Ausgangsstoffe neu an, bleiben dabei aber erhalten.
b Thomson wies experimentell nach, dass Atome noch kleinere und negativ geladenen Teilchen abgegeben können, die Elektronen. Er entwickelte deshalb das Rosinenkuchenmodell, laut dem die negativ geladenen Elektronen in einer positiv geladenen Masse eingebettet sind, weshalb das Atom nach außen hin elektrisch neutral ist.
c „Bei chemischen Reaktionen bleibt die Masse gleich.“ → Atommodell von Dalton: Atome sind unteilbare, kugelförmige Teilchen, die bei chemischen Reaktionen weder zerstört noch erzeugt werden. Daher bleibt die Masse gleich.
„Edelgase sind reaktionsträge.“ → Schalenmodell: Edelgase haben eine voll besetzte Außenschale, was eine besonders stabile Elektronenanordnung darstellt und sie daher reaktionsträge macht.
„Körper lassen sich durch Reibung elektrisch aufladen.“ → Rosinenkuchenmodell: Atome enthalten kleinere, negativ geladene Teilchen (Elektronen), die durch Reibung von einem Körper auf einen anderen übertragen werden können.
a Im Schalenmodell bewegen sich die Elektronen in bestimmten Aufenthaltsbereichen um den Atomkern. Diese Bereiche sind im Modell wie Schalen angeordnet. Jede Schale kann nur eine bestimmte Anzahl von Elektronen aufnehmen, und die Schalen werden von innen nach außen mit Elektronen aufgefüllt.
b 1. Schale: 2 Elektronen; 2. Schale: 8 Elektronen
c Schwefelatom mit 16 Protonen und 16 Elektronen
d
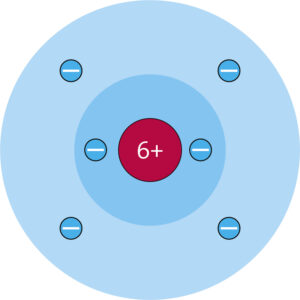
a Die Ordnungszahl gibt die Anzahl der Protonen eines chemischen Elements an. Die Massenzahl ist die Summe der Protonen- und Neutronenzahl eines Atoms.
b Die Hauptgruppennummer gibt die Anzahl der Außenelektronen eines Atoms an.
c Die Elemente einer Hauptgruppe besitzen ähnliche Eigenschaften, weil sie die gleiche Anzahl an Außenelektronen haben. Die Außenelektronen bestimmen die chemischen Eigenschaften eines Elements, da sie an chemischen Reaktionen teilnehmen. Daher haben Elemente mit der gleichen Anzahl an Außenelektronen ähnliche chemische Eigenschaften.
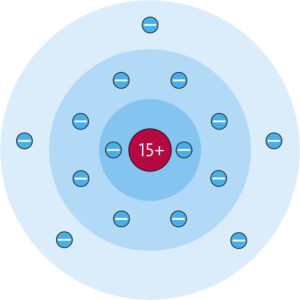
d Chlor befindet sich im Periodensystem in der 7. Hauptgruppe und in der 3. Periode. Das bedeutet, dass ein Chloratom sieben Außenelektronen und drei Elektronenschalen besitzt. Die Ordnungszahl von Chlor ist 17, was bedeutet, dass es 17 Protonen und 17 Elektronen hat. Chlor ist ein Halogen und daher sehr reaktionsfreudig, da es nur ein Elektron benötigt, um eine voll besetzte Außenschale zu erreichen.
e Das Element, das 20 Elektronen in seiner Atomhülle hat, ist Calcium. Es befindet sich in der 4. Periode und in der 2. Hauptgruppe des Periodensystems.