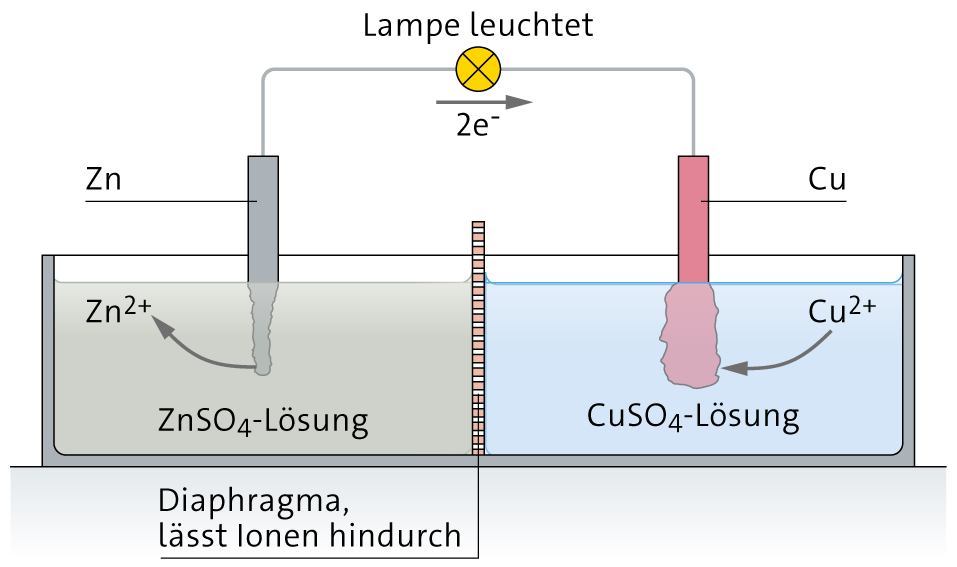
Redoxreaktion
Wenn bei Redoxreaktionen Ionen beteiligt sind, ist die Elektronenabgabe und -aufnahme einfach zu erkennen.
Elektronenabgabe und Elektronenaufnahme können dabei auch an verschiedenen Stellen stattfinden (siehe unten). Für den elektrischen Ausgleich diffundieren in dem gezeigten Aufbau negativ geladene Sulfationen durch das Diaphragma.

Redoxreaktion treibt Motor
Wenn man statt des Diaphragmas genügend breite Filterpapierstreifen zwischen die Becken hängt und eine große Zinkplatte sowie eine große Kupferplatte nimmt, fließt so viel Strom, dass man einen kleinen Elektromotor betreiben kann.
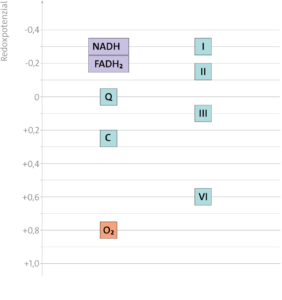
Redoxpotenzial
Das Redoxpotenzial, gemessen in Volt, ist ein durch Versuche ermitteltes Maß dafür, ob ein Stoff in einer Redoxreaktion Elektronen an einen anderen abgeben kann. Stoffe mit negativerem Potenzial können Elektronen an Stoffe mit positiverem Potenzial abgeben.
Das Redoxpotenzial von Zink beträgt -0,76 V, das von Kupfer +0,35 V.
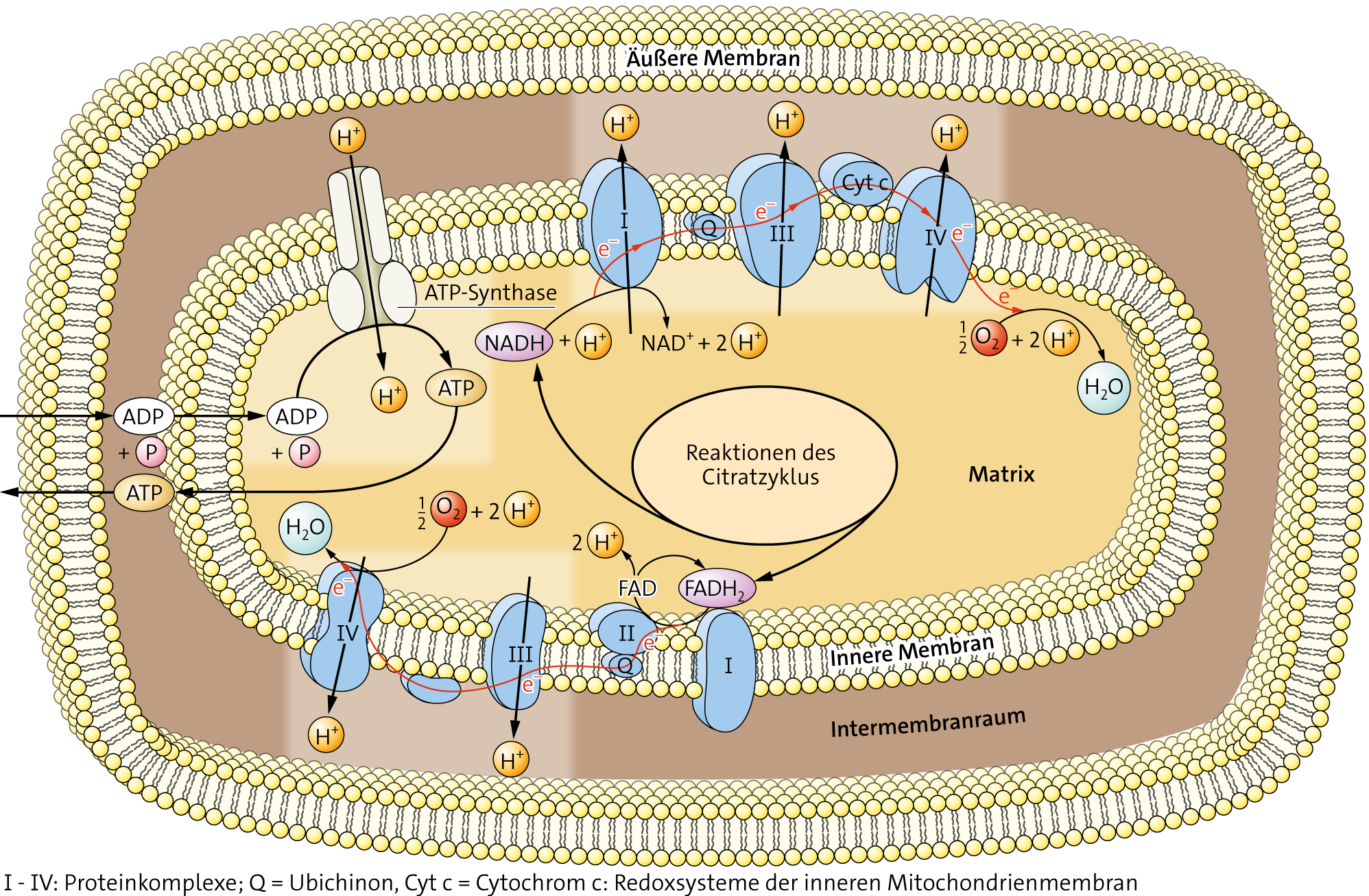
Redoxsysteme in der Atmungskette
Auch für die Redoxsysteme der Atmungskette (siehe unten bei den Aufgaben) hat man Redoxpotenziale ermittelt (siehe links).
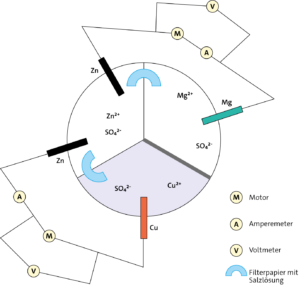
Versuchsprinzip:
In einer dreigeteilten Schale tauchen Stäbe von drei verschiedenen Metallen in Lösungen mit ihren Sulfaten. Die mit Salzlösung getränkten Filterpapiere ermöglichen, dass Ionen wandern. Das Redoxpotenzial von Magnesium beträgt
-2,38 V.
Beobachtung:
Beim abgebildeten Versuchsaufbau laufen die beiden Motoren, wenn die Elektroden und die Filterpapierstreifen groß genug sind (siehe oben). An den Voltmetern werden Spannungen gemessen und an den Amperemetern Stromflüsse.
Aufgaben:
Autor: Martin Post