Lösungen zu Check-up
Kapitel 6 Naturstoffe
________________________________________________________
Seite 117
Kohlenhydrate
Aufgabe 1
a Rhamnose, Glucose und Fructosemolekül: je sechs C-Atome Glucose und Rhamnosemolekül: Aldehydgruppe am C-1-Atom ⇨ Aldosen; Fructosemolekül: Ketogruppe am C-2-Atom ⇨ Ketose. Rhamnosemolekül: die Hydroxygruppe am C-6-Atom ist durch ein H-Atom ersetzt ⇨ Desoxyzucker mit der Molekülformel C6H12O5 (im Vergleich zur Molekülformel von Glucose und Fructose: C6H12O6)
b
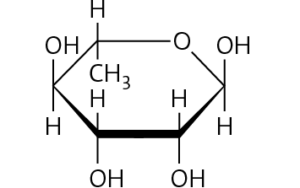
c Der Grundaufbau der Moleküle der Monosaccharide (Einfachzucker) besteht aus einem Kohlenstoffgerüst mit drei bis sieben Kohlenstoffatomen. Alle Moleküle enthalten eine Carbonyl gruppe –CO–, die entweder mit dem C-1- oder dem C-2-Atom verknüpft ist, sowie jeweils eine Hydroxygruppe –OH an jedem weiteren Kohlenstoffatom. Aufgrund der fehlenden OH-Gruppe am C6Atom weicht das Rhamnosemolekül von dieser Grundstruktur ab. Da es aber am C-1-Atom eine Aldehydgruppe auf weist und darüber hinaus am C-2- bis C-5-Atom jeweils eine Hydroxygruppe trägt, wird Rhamnose zu den Zuckern, genauer den um ein Sauerstoffatom geminderten Zuckern, den Desoxyzuckern, gezählt.
Aufgabe 2
a und b
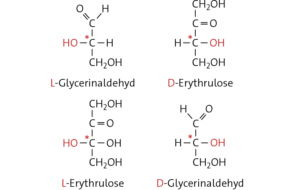
c Namen der in der Aufgabe abgebildeten Fischer-Projektions formeln:
D-Idose (links), D-Glucose (2. v. links), L-Idose (2. v. rechts), L-Glucose (rechts).
D-Idose, D-Glucose und L-Glucose sind Diastereomere. D-Idose und L-Idose sowie D-Glucose und L-Glucose sind Enantiomere.
d Moleküle, die sich wie Bild und Spiegelbild verhalten, sind Enantiomere (Spiegelbildisomere). Sie lassen sich durch Drehen der Moleküle nicht zur Deckung bringen.
Von Molekülen mit mehreren Chiralitätszentren gibt es auch Stereoisomere, die nicht wie Bild und Spiegelbild sind und als Diastereomere bezeichnet werden. Beispiel: D-Glucose und L Glucose sind zueinander Enantiomere. Zur Aldohexose D-Glucose gibt es 15 weitere Diastereomere, ebenso zur L-Glucose usw.
⇨ Alle 16 Aldohexosen sind zueinander Diastereomere.
Aufgabe 3
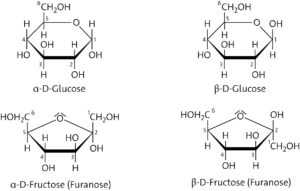
Durch den Ringschluss des kettenförmigen Glucosemoleküls wird das C-1-Atom der Aldehydgruppe zu einem weiteren asymmetrisch substituierten Kohlenstoffatom. Dadurch sind zwei Isomere möglich, die Anomere α-D-Glucose und β-D-Glucose. Es sind keine spiegelbildlichen Enantiomere, wie es D-Glucose oder L-Glucose sind, sondern Diastereomere.
α-D-Glucose und β-D-Glucose unterscheiden sich in ihren physikalischen und chemischen Eigenschaften, z. B. zeigen die beiden Anomere unterschiedliche Schmelztemperaturen. Ihre Lösungen unterscheiden sich in ihrem Drehwinkel, während D- und L-Glucose sich nur im Vorzeichen des Drehwinkels unterscheiden und gleiche Schmelztemperaturen besitzen. α-D-Glucose reagiert zu Stärke, während β-D-Glucose Cellulose bildet.
Aufgabe 4
a D-Mannose ist ein Diastereomer zu D-Glucose, das sich nur in der Stellung der OH-Gruppe am C-2-Atom unterscheidet. D-Mannose ist eine Aldohexose, D-Fructose ist dagegen eine Ketohexose. Die einzigen Übereinstimmungen zwischen den beiden Molekülen sind die Stellungen der OH-Gruppen am C-3-, C-4-, C-5-Atom.
b
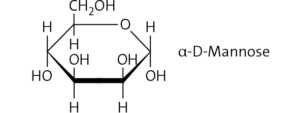
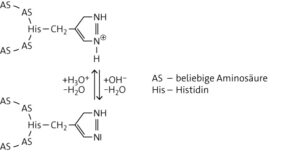
c Es hat eine Keto-Enol-Tautomerie stattgefunden. Durch die Natronlauge sind katalytisch wirkende OH-Ionen in der Lösung vorhanden, die bewirken, dass am C-1-Atom des Mannosemoleküls ein Proton abgespalten und zwischen dem C-1- und C-2-Atom eine Doppelbindung gebildet wird. Das abgespaltene Proton kann nun an das Sauerstoffatom der Ketogruppe binden. Das bei dieser intramolekularen Umlagerung entstandene Zwischenprodukt ist ein Endiol.
Die Endiolform ist nicht sehr stabil. Jeweils eine der Hydroxygruppen kann wieder deprotoniert und dadurch eine Carbonylgruppe zurückgebildet werden. Wird dabei das Proton der Hydroxygruppe am C-2-Atom abgespalten und an die Doppelbindung addiert, bildet sich die Fructose. Wird aber das Proton der Hydroxygruppe am C-1-Atom abgespalten, bildet sich die Aldehydgruppe am C-1-Atom und es entsteht durch Isomerisierung ein Aldehyd – entweder die Glucose oder die Mannose, da am C-2-Atom die Hydroxygruppe auch in umgekehrter Konfiguration entstehen kann. Da alle beteiligten Reaktionen Gleichgewichtsreaktionen sind, stellt sich mit der Zeit ein Gleichgewicht zwischen Mannose, Fructose und Glucose ein.
Aufgabe 5
a und b
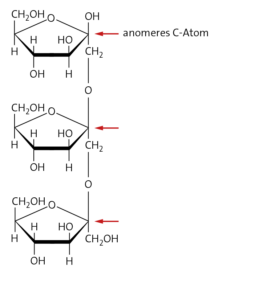
c Die anomeren Kohlenstoffatome des Oligofructosemoleküls sind an der glykosidischen Bindung beteiligt (Acetal). Die Fehling Probe wird negativ ausfallen.
Aufgabe 6
a Als glykosidische Bindung bezeichnet man die chemische Bindung zwischen dem anomeren C-Atom eines Monosaccharidbausteins mit einem C-Atom eines zweiten Monosaccharidbausteins. Sie entsteht aus den jeweiligen glykosidischen OH-Gruppen der beiden Monosaccharidbausteine. Im Gentiobiosemolekül liegt z. B. eine β-1,6-glykosidische Bindung vor. Dies besagt, dass ein β-D-Glucosemolekül über sein C-1-Atom mit dem C-6-Atom des β-D-Glucosemoleküls verbunden ist.
b
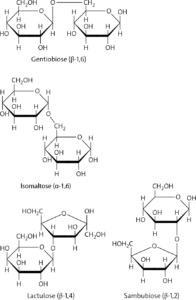
c Bei der Verknüpfung von zwei D-Glucosebausteinen ergeben sich viele Verknüpfungsmöglichkeiten, da D-Glucose in zwei anomeren Formen, α- und β-D-Glucose, existiert. Die anomeren C-Atome können außerdem mit unterschiedlichen OH-Gruppen des zweiten Glucosebausteins reagieren. Damit ergeben sich allein für die Verknüpfung von zwei Glucosebausteinen drei nicht reduzierende und 8 reduzierende Disaccharide.
Aufgabe 7
a In beiden Molekülen liegt zwischen den Monosaccharidbausteinen eine β-1,4-glykosidische Verknüpfung vor. Beide bilden gerade Molekülketten. Die Monosaccharidbausteine im Chitinmolekül weisen am C-2-Atom eine Acetamidogruppe auf, die sich in dieser Hinsicht von der β-Glucose unterscheidet. Die Bindung der Monomere ist wie bei der Cellulose β-glykosidisch. Chitin ist also ähnlich aufgebaut wie Cellulose und kann als Derivat der Cellulose aufgefasst werden.
b Cellulosemoleküle verfügen über viele freie OH-Gruppen. Dadurch können sich Wassermoleküle zwischen die Celluloseketten einlagern. Cellulose kann eine beträchtliche Menge Wasser aufnehmen. Im Chitinmolekül ist das Wasserbindungsvermögen stark eingeschränkt, da die Acetamidogruppe (NHCOCH3-Gruppe) hydrophob ist. Wäre das Exoskelett aus Cellulose, würden Insekten bei Kontakt mit Wasser aufquellen.
Aufgabe 8
a α-D-Glucose
b Natürlich vorkommende Stärke besteht aus einem Gemisch aus Amylose (ca. 25 %) und Amylopektin (ca. 75 %).
Amylosemoleküle: unverzweigte Makromoleküle von 500 bis 1200 D-Glucosebausteinen, die α-1,4-glykosidisch verknüpft sind. Amylose ist in heißem Wasser löslich (lösliche Stärke).
Amylopektinmoleküle: verzweigte Makromoleküle aus bis zu 1 000 000 Glucosebausteinen, die α-1,4-glykosidisch verknüpft sind und zusätzlich im Abstand von etwa 25 Glucosebausteinen eine Verzweigung in α-1,6-glykosidische Bindung aufweisen. Be dingt durch die Größe seiner Moleküle ist Amylopektin nicht wasserlöslich. Es ist jedoch quellfähig und kann deshalb große Mengen Wasser binden.
c Versetzt man natürlich vorkommende Stärke mit Lugol’scher Lösung (Iod-Kaliumiodidlösung), so erkennt man eine dunkel blaue Färbung. Dieser Stärkenachweis beruht auf einer Einlagerungsverbindung der Amylose mit Triiodid-Ionen, die in Lugol’scher Lösung enthalten sind. Die Amylosemoleküle bilden eine Spirale, in deren Inneres sich Triiodid-Ionen (I3−) einlagern und so die blaue Färbung verursachen.
d Amylosemoleküle bestehen aus vielen Hundert Glucosebausteinen und Amylopektin aus bis zu einer Million Glucosebausteinen, die über die glykosidischen Gruppen verknüpft sind. Diese sind durch die Bindung blockiert und können nicht reduzierend wirken. Jedes Molekül hat an seinem Ende aber eine freie glykosidische Gruppe, die reduzierend wirken kann. Im Verhältnis zu den riesigen Stärkemolekülen kommen sie jedoch in zu geringer Anzahl vor, um eine positive Fehling-Probe zu ermöglichen.
________________________________________________________
Seite 118
Aufgabe 9
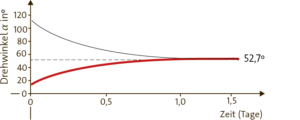
a Der Drehwinkel der 10%igen α-D-Glucoselösung sinkt stetig innerhalb von anderthalb Tagen von einem Ausgangswert mit etwa 110° auf einen Wert von 52,7°. Ist der Drehwinkel von 52,7° erreicht, ändert er sich nicht mehr.
b In wässrigen Lösungen wird die α-D-Glucose über die Kettenform in die β-D-Glucose umgewandelt. Im Verlauf dieser Isomerisierung bildet sich ein chemisches Gleichgewicht aus. Bei einem Drehwinkel von 52,7° ist der Gleichgewichtszustand erreicht.
c Das Gleichgewicht stellt sich von der anderen Seite her ein, nämlich von der β-D-Glucose (rote Kurve).
Aufgabe 10
a Durch verdünnte Säuren kann ein Trisaccharid hydrolytisch an glykosidischen Bindungen gespalten werden. Bei kurzem Einwirken der Säure wird nur eine glykosidische Bindung gespalten und als Reaktionsprodukt wird ein Disaccharid und ein Monosaccharid erhalten. Bei längerem Einwirken der Säure werden beide glykosidischen Bindungen des Trisaccharidmoleküls gespalten und als Reaktionsprodukte werden drei Monosaccharide gebildet.
b Reihenfolge der Monosaccharidbausteine im untersuchten Trisaccharid:
Möglichkeit I: Glucose-Fructose-Glucose
Möglichkeit II: Glucose-Glucose-Fructose
c In der Beschreibung des Versuchs wird ausgeführt, dass eines der Disaccharide eine positive Fehling-Probe ergibt, das andere jedoch nicht. Beim untersuchten Trisaccharid muss es sich um Möglichkeit II handeln, da hier sowohl Maltose (zwei Glucosebausteine) als auch Saccharose (ein Glucose und ein Fructosebaustein) als Disaccharide entstehen können. Beim Maltosemolekül ist das C-1-Atom des zweiten Glucosebausteins frei, sodass dort eine Ringöffnung erfolgen kann. Maltose wirkt deshalb reduzierend und die Fehling-Probe fällt positiv aus. Beim Saccharosemolekül liegen keine freien glykosidische Gruppen vor und auch die reaktiven C-Atome beider Monosaccharidbausteine sind glykosidisch gebunden. Die Fehling-Probe verläuft daher negativ.
Aufgabe 11
a Durch die im Zitronensaft katalytisch wirkenden Säuren kann die Saccharose hydrolytisch gespalten werden.
C12H22O11 + H2O ⟶ 2 C6H12O6
b Es entstehen Glucose und Fructose. Invertzucker ist ein Gemisch aus Glucose und Fructose im Verhältnis 1:1.
c Glucose ist mit den Glucoseteststäbchen nachweisbar. Die Reaktion kann durch Messung des Drehwinkels verfolgt werden.
_____________________________________________
Seite 119
linke Spalte – Zwei Disaccharide im Vergleich
Aufgabe 1
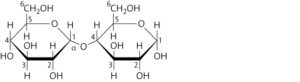
Die beiden α-D-Glucosebausteine sind über eine α-1,4-glykosidische Bindung miteinander verbunden.
Aufgabe 2
I) Die Prüfung der Zucker mit Glucoseteststreifen ergibt ein negatives Ergebnis bei Maltose und Trehalose.
Hinweis: Bei tatsächlich durchgeführten Experimenten ergibt der GOD-Test auf Maltose teilweise ein schwach positives Ergebnis.
II) Die Prüfung der Zucker mit Fehling-Lösung ergibt ein positives Ergebnis bei Maltose und ein negatives bei Trehalose.
III) Nachdem jeder der Zucker in einer mit Salzsäure angesäuerten Lösung erhitzt wurde, zeigen beide Zucker ein positives Ergebnis (hohe Glucosekonzentration) ⇒ hydrolytische Spaltung der Zucker zu Glucose.
Aufgabe 3
Das Disaccharid Maltose ist ein reduzierender Zucker, weil eine der cyclischen Strukturen sich am anomeren C-1-Atom öffnen und eine kettenförmige Struktur entstehen kann.
Das Disaccharid Trehalose ist ein nichtreduzierender Zucker. Beide Glucosebausteine müssen so verknüpft sein, dass eine Ringöffnung nicht erfolgt.
Aufgabe 4
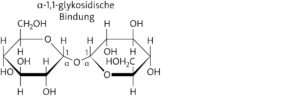
Das Trehalosemolekül besteht aus zwei Glucosebausteinen (Versuchsergebnis III). Die glykosidische Bindung muss über beide anomeren C-Atome (C-1-Atome) erfolgen. Demzufolge liegt eine α-1,1-glykosidische Bindung vor.
Hinweis: Aus den Versuchsergebnissen könnte auch eine β-1,1- oder α-1,β-1-glykosidische Bindung abgeleitet werden, die ebenfalls einen nichtreduzierenden Zucker begründen würde.
rechte Spalte – Reifung von Äpfeln
Aufgabe 1
Aufgabe 2
Bei Versuch A) wird über den pH-Wert die H3O+-Konzentration aller enthaltenen Säuren bestimmt.
In Versuch B) wird der Gehalt der Äpfelsäure ermittelt.
In Versuch C) Wird die Art und der Anteil der enthaltenen Zucker, vor allem Glucose und Fructose, untersucht.
Aufgabe 3
Anhand der pH-Wert-Bestimmung in Versuch A kann die Gesamtkonzentration der Oxonium-Ionen, beispielsweise aus der Reaktion von Äpfelsäure mit Wasser, bestimmt werden.
Entsprechend dem Ergebnis enthält der unreife Apfel
mehr Oxonium-Ionen, c(H3O+) = 10-3 mol ∙ l-1 (pH = 3), als der reife Apfel, c(H3O+) = 10-4 mol ∙ l-1 (pH = 4).
Durch die Bestimmung des Gehalts an Äpfelsäure kann Versuchsergebnis A qualitativ bestätigt werden. Der unreife Apfel enthält mit 100 mg/dl doppelt so viel Äpfelsäure wie der reife Apfel (50 mg/dl).
In Versuch C zeigt die positive Fehling-Probe beim reifen Apfel den höheren Gehalt an reduzierenden Zuckern, beispielsweise Glucose, an. Beim unreifen Apfel hingegen ist unklar ob die Fehling-Probe positiv oder negativ verlaufen ist.
Mit der Seliwanow-Probe wird der Gehalt an Fructose nachgewiesen. Beim reifen Apfel fällt die Seliwanow-Probe eindeutig positiv aus, beim unreifen Apfel ist das Ergebnis weniger deutlich. Die Probe mit reiner Äpfelsäure dient als Blindprobe. Schlussfolgerung aus der Untersuchung der zwei Äpfel: Unreife Äpfel enthalten mehr (Äpfel-)säure als reife; der Gehalt an reduzierenden Zuckern wie Glucose ist bei reifen Äpfeln höher als bei unreifen; ebenso der Gehalt an Fructose.
Aufgabe 4
Die Fragestellung für den Wettbewerb „Jugend forscht“ lautete: Was verändert sich im Apfel während des Reifungsprozesses?
Die experimentelle Vorgehensweise ist zu kritisieren:
– Es wurden Äpfel von Jahrgängen verwendet (reifer Apfel aus dem Vorjahr) sowie vermutlich auch von verschiedenen Sorten verwendet. Durch die lange Lagerung verändern sich möglicherweise die Inhaltsstoffe. Zumindest hätte darauf geachtet werden müssen, dass die Äpfel von der gleichen Sorte (noch besser: vom selben Baum) stammen.
– Es wurden zwar wesentliche Stoffe bzw. Stoffgruppen untersucht (Äpfelsäure, Säure gesamt, reduzierende Zucker, Fructose), aber nicht alle. Aus Text M2.1 ist zu entnehmen, dass noch weitere Stoffe für den erfrischenden Geschmack und den Nährstoffwert wichtig sind, beispielsweise Vitamin C und Spurenelemente. Diese wurden nicht untersucht.
Die Schülerinnen und Schüler hätten für ein aussagekräftigeres Ergebnis und zur Beantwortung der Fragestellung Äpfel eines Baums nehmen müssen, die Lagerzeit unreif-reif minimieren (Juli bis September) und weitere Stoffe wie Vitamin C untersuchen müssen.
_____________________________________________
Seite 120
Aminosäuren und Proteine
Aufgabe 1
a Die Moleküle der proteinogenen Aminosäuren haben am α-Kohlenstoffatom (mit Ausnahme von Glycin) ein asymmetrisches C*-Atom, an dem vier unterschiedliche Substituenten gebunden sind. Dadurch sind Aminosäuren chiral und es existieren von diesen Aminosäuren zwei unterschiedliche Enantiomere, die sich wie Bild und Spiegelbild verhalten: D- und L-Aminosäuren.
b Für die Proteinbiosynthese der Lebewesen werden ausschließlich die L-Aminosäuren zum Aufbau von Proteinen genutzt.
Aufgabe 2
Aufgrund ihrer zwitterionischen Struktur zeigen Aminosäuren ähnliche Eigenschaften wie Salze: Zwischen den Aminosäuremolekülen bestehen Ionenbindungen, die durch die positive Ladung der Ammoniumgruppen und die negative Ladung der Carboxylatgruppen bei der Zwitter-Ionenform resultieren. Dadurch kristallisieren die Aminosäuren im festen Zustand im Ionengitter.
Zum Aufbrechen der Ionengitter ist eine große Energiezufuhr notwendig, um die Aminosäuren in den flüssigen Aggregatzustand zu überführen.
Aufgabe 3
a Die negativ geladene Carboxylatgruppe des Zwitter-Ions von Valin reagiert als Protonenakzeptor und somit basisch. Die Ammoniumgruppe fungiert als Protonendonator und reagiert somit sauer.
b Saure Aminosäuren enthalten in den Seitenketten ihrer Moleküle eine zusätzliche Carboxygruppe, basische hingegen eine weitere Aminogruppe. Neutrale Aminosäuren besitzen Seitenketten mit unpolaren Kohlenwasserstoffresten (ausschließlich C-und H-Atome gebunden) oder polaren Kohlenwasserstoffresten (zusätzlich O-, S-, N- oder Se-Atome).
Beispiele neutrale Aminosäuren: Serin, Prolin etc.
Saure Aminosäuren: Asparaginsäure, Glutaminsäure
Beispiele basische Aminosäuren: Lysin, Arginin etc.
Aufgabe 4
a H2N–CH(–CH3)–COO− + H3O+ + Cl− ⟶ H3N+–CH(–CH3)–COOH + H2O + Cl−
b pH = 3,5: zur Kathode; pH = 6,11: keine Wanderung; pH = 9: zur Anode
Aufgabe 5
a Ein Molekül Glutathion besteht aus den Aminosäurebausteinen Glutaminsäure, Cystein und Glycin.
b Kondensation:
H2N–CH(–CH2–SH)–COOH + H2N–CH2–COOH ⟶ H2N–CH(–CH2–SH)–CO–NH–CH2–COOH + H2O
c Die Peptidbindung zwischen dem Cystein- und Glycinbaustein erfolgt über die Carboxygruppe am α-C-Atom von Cystein. Dies ist der Normalfall. Die Peptidbindung zwischen dem Glutaminsäure- und Cysteinbaustein weicht davon ab, denn hier erfolgt die Bindung zwischen der zusätzlichen Carboxygruppe in der Seitenkette der Glutaminsäure (Hinweis: γ-Carboxygruppe). Bei Gluthathion handelt es sich um kein reguläres Peptid, da es eine irreguläre Peptidbindung aufweist.
d Aufgrund der zwei freien Carboxygruppen am Glutaminsäurerest gibt es zwei Möglichkeiten, ein Peptid aus sechs Aminosäurebausteinen zu bilden:
Glu-Cys-Gly-Glu-Cys-Gly und
Glu-Cys-Glu-Glu-Cys-Gly
Aufgabe 6
Peptid: Verbindung aus mindestens zwei Aminosäuren; bis 10 Aminosäurebausteinen spricht man von Oligopeptiden. Polypeptid: Verbindung aus 10 bis 100 Aminosäurebausteinen. Proteine sind makromolekulare Stoffe, deren Molekül aus mehr als 100 Aminosäurebausteinen bestehen.
Aufgabe 7
| Struktur | Wirkende Bindung |
| Primärstruktur | Peptidbindung zwischen der Amino- und der Carboxygruppe der Aminosäuren |
| Sekundärstruktur | Wasserstoffbrücken zwischen CO- und NH-Gruppen verschiedener Peptidgruppen:
|
| Tertiärstruktur | Wechselwirkungen zwischen den Resten der Aminosäuren durch: Elektronenpaarbindungen Ionenbindungen
Wasserstoffbrücken Van-der-Waals-Kräfte |
| Quartärstruktur | wie Tertiärstruktur |
Aufgabe 8
Proteine können in Globuläre Proteine und Fibrilläre Proteine aufgeteilt werden.
Globuläre Proteine:
– kugelförmige Makromoleküle
– wasserlöslich
– Funktionsproteine: Transport, Steuerung, Abwehr: Peptidhormone, Enzyme
– Beispiele: Hämoglobin, Katalase, Albumin
Fibrilläre Proteine:
– faserartige, längliche
Makromoleküle
– nicht wasserlöslich
– Strukturproteine: Muskel-, Horn-, Gewebeaufbau
– Beispiele: Kollagen, Keratin, Spidroin, Naturseide
Aufgabe 9
Naturseide hat Faltblattstruktur. Glycin (keine Seitenkette) und Alanin (kleine Seitenkette, –CH3) begünstigen in Naturseide die Ausbildung der Faltblattstruktur.
Aufgabe 10
a Kollagen ist ein fibrilläres Strukturprotein, das aus einer verdrillten Dreifachhelix besteht. Die Polypeptidketten sind über Wasserstoffbrücken stabilisiert. Mehrere dieser Kollagenfibrillen liegen nebeneinander und bilden die Kollagenfaser. Kollagen besitzt aufgrund dieser Struktur eine große Zugfestigkeit und ist nicht wasserlöslich.
b Wird Kollagen zusammen mit Wasser erhitzt, so lösen sich die nur durch Wasserstoffbrücken stabilisierten Polypeptidketten der Dreifachhelix partiell auf und entspiralisieren sich. Dabei entsteht eine zufällige Knäuelstruktur. Dieses (denaturierte) Protein wird als Gelatine bezeichnet. Zwischen den polaren Seitenketten der Polypeptidmoleküle und den Wassermolekülen können sich Wasserstoffbrücken bilden. Es kommt zur Bildung eines Hydrogels, einer gelierten Lösung. Durch Erwärmen auf etwa 50 °C wird Gelatine wasserlöslich.
Aufgabe 11
a Enzyme sind Proteine, die unter physiologischen Bedingungen als Biokatalysatoren wirken. Sie ermöglichen spezifische chemische Reaktionen (Wirkungsspezifität).
b Funktion der Salzsäure: Denaturierung der Proteine in der Nahrung, dabei werden die Ionenbindungen zwischen den Carboxylat- und Ammoniumgruppen zerstört; außerdem hydrolytische Spaltung der Proteine.
Funktion des Enzyms Peptidase: Hydrolytische Spaltung der Proteine.
c Hydrolyse:
Protein–NH–CO–CH(–R)–NH2 + H2O
⇒ Enzym ⇒
⟶ Protein–NH2 + COOH–CH(–R)–NH2
d Die Hydrolyse ist eine exotherme Reaktion und läuft vermutlich bereits unter Einwirkung der Salzsäure auch ohne Peptidase ab. Möglicherweise besitzt die Reaktion aber eine hohe Aktivierungsenergie und die Reaktionsgeschwindigkeit ist gering. Durch die Beteiligung der Peptidase, einem Biokatalysator, wird die Reaktionsgeschwindigkeit erhöht, sodass die Hydrolyse mit für den Stoffwechsel geeigneter Geschwindigkeit und bei Körpertemperatur ablaufen kann.
_____________________________________________
Seite 121
linke Spalte – Proteine im Blut
Aufgabe 1
a Albumin ist ein zu einer Helix aufgewundenes Polypeptid, das eine annähernd kugelförmige Tertiärstruktur besitzt. Es gehört damit zu den globulären Proteinen.
b
| Albumin (globuläres Protein) | z. B. Kollagen (fibrilläres Protein) |
| Struktur | |
| – annähernd kugelförmig; Tertiärstruktur geknäuelt | – länglich, faserartig, verdrillte Dreifachhelix |
| Eigenschaften und Funktionen | |
| – kolloidal löslich; – eignen sich daher z. B. für Transport, Steuerung |
– unlöslich, durch zahlreiche intermolekulare Wasser- stoffbrücken sehr fest; – eignen sich zur Strukturbildung (Muskeln, Sehnen, Haare) |
Aufgabe 2
a Bei globulären Proteinen wie dem Albumin ragen die unpolaren Seitenketten in das Innere der Tertiärstruktur während die polaren Seitenketten nach außen weisen. An die polaren Seitenketten können sich Wassermoleküle anlagern. Dies erklärt die große Kapazität von Albumin, Wasser zu binden.
b Ist die Konzentration an Albumin im Blutplasma zu gering, sinkt die Fähigkeit des Blutplasmas, Wasser zu binden. Das mit Getränken und Nahrung aufgenommene Wasser wird dann nicht im Blutplasma, sondern außerhalb der Blutgefäße, im Gewebe, gespeichert, wo es zu Wasseransammlungen (Ödemen) kommen kann.
Aufgabe 3
Aufgabe 4
Ein Gemisch der verschiedenen Proteine des Bluts wird auf einem Gel aus Polyacrylnitril als Trägermaterial aufgetragen. Das Gel wird mit einer Pufferlösung getränkt, die auf einen konstanten pH-Wert eingestellt ist. Dann wird ein elektrisches Feld angelegt. Die unterschiedlich geladenen und unterschiedlich großen Proteinmoleküle wandern unterschiedlich schnell durch das dreidimensionale Netzwerk des Gels. Proteinmoleküle mit vielen negativ geladenen COO−-Gruppen wandern zum Pluspol, solche mit positiv geladenen NH3+-Gruppen zum Minuspol. So kommt es zu einer charakteristischen Auftrennung der im Blut enthaltenen Proteine, die durch spezifische Farbreaktion (Ninhydrin) dargestellt werden können.
Aufgabe 5
Alaun enthält K+– und Al3+-Ionen, die denaturierend auf Proteine wirken. Dadurch verklumpen die Proteine des Bluts, sodass es schneller zu einem Wundverschluss und damit zum Stoppen der Blutung kommt.
rechte Spalte – Friseure als Chemiker
Aufgabe 1
Es liegt eine Peptidbindung vor (grau unterlegt).
Aufgabe 2
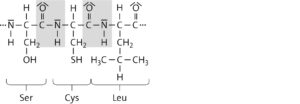
Das α-Keratinmolekül besteht aus einer Polypeptidkette, in der die Aminosäurebausteine linear angeordnet sind. Art, Anzahl und Reihenfolge der Aminosäurebausteine sind in der Aminosäuresequenz festgelegt; z. B. im genannten Ausschnitt Ser Cys Leu . Die Aminosäuresequenz entspricht der Primärstruktur des Proteins.
Die Polypeptidkette von α-Keratin ist zu einer rechtsgängigen α-Helixstruktur aufgewunden, die durch intramolekulare Wasserstoffbrücken stabilisiert wird. Dies entspricht der Sekundärstruktur des Proteins. Mehrere α-Helices sind durch Disulfidbrücken miteinander verbunden und zu einer linksgängigen Superhelix verwunden. Dies entspricht der Quartärstruktur des Proteins.
Aufgabe 3
Zunächst wird ein Teil der Disulfidbrücken durch Reduktionsmittel gespalten. Die Cysteinbausteine verfügen dann über je eine Thiolgruppe:
0 0 -I
Cys-S-S-Cys + 2 H+ + 2 e– → 2 Cys-SH
Es handelt sich um eine Redoxreaktion, da sich die Oxidationszahl der Schwefelatome im Protein von 0 auf I ändert.
Das Haar wird in Form gelegt und durch ein Oxidationsmittel wie Wasserstoffperoxid dauerhaft fixiert. Dabei werden Disulfidbrücken an anderer Stelle gebildet:
-I 0 0
2 Cys-SH → Cys-S-S-Cys + 2 H+ + 2 e–
Es handelt sich auch hier um eine Redoxreaktion, da sich die Oxidationszahl des Schwefelatoms im Protein von I auf 0 ändert.
_____________________________________________
Seite 122
Fette und Tenside
Aufgabe 1
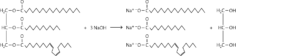
a Reaktionsgleichung:
b Es gilt: Je höher der Gehalt an gebundenen ungesättigten Fettsäuren in einem Fett ist, desto niedriger liegt sein Schmelzbereich, weil sich Fettmoleküle mit gewinkelten Fettsäureresten nicht dicht aneinanderlegen können und geringere Van-der-Waals-Kräfte als bei Fettmolekülen mit geraden, gesättigten Fettsäureresten wirken. Fette mit gesättigten Fettsäureresten sind deswegen bei Raumtemperatur fest und es erfordert thermische Energie, um die Anziehungskräfte zu überwinden und das Fett zum Schmelzen zu bringen.
Schweineschmalz besteht zu 45 % aus einfach ungesättigten Fettsäuren, zu 8 % aus mehrfach ungesättigten Fettsäuren und zu 43 % aus gesättigten Fettsäuren. Zwischen den Molekülen des Schweinschmalzes wirken relativ starke Van-der-Waals-Kräfte: Das Fett ist bei Raumtemperatur fest (streichfähig).
Sonnenblumenöl dagegen besteht zu 57 % aus mehrfach ungesättigten Fettsäuren, zu 27 % aus einfach ungesättigten Fettsäuren und nur zu 16 % aus gesättigten Fettsäuren. Zwischen den Molekülen des Sonnenblumenöls wirken daher nur schwächere Van-der-Waals-Kräfte: Das Fett ist bei Raumtemperatur flüssig.
Aufgabe 2
Pro-Argumente: Margarine besteht heute aus rein pflanzlichen Fetten; dies wirkt sich wegen der höheren Anteile an ungesättigten Fettsäuren im Vergleich zu Fetten tierischer Herkunft positiv auf die Gesundheit aus. Tierschutz: Es müssen weniger Tiere gehalten (z. B. Milchwirtschaft: Butter) oder geschlachtet werden (z. B. Schweineschmalz).
Kontra-Argumente: Um Margarine streichfähig zu machen, müssen die pflanzlichen Fette gehärtet werden: Reduktion des Anteils ungesättigter Fettsäuren, Anteil der gesättigten steigt. Außerdem ist die Fetthärtung ein chemischer Prozess, bei dem gesundheitlich bedenklich Transfette entstehen können.
Aufgabe 3
Tensidmoleküle bestehen aus einem polaren, hydrophilen bzw. lipophoben Teil („Kopf“) und einem unpolaren, lipophilen bzw. hydrophoben Teil („Schwanz“). Die Struktur des „Kopfs“ bestimmt die Zugehörigkeit des jeweiligen Tensidmoleküls zu verschiedenen Tensidklassen (anionische, kationische, zwitterionische oder nichtionische Tenside). Die Struktur des „Schwanzes“ besteht meist aus einer langen, oft unverzweigten Alkylgruppe.
Aufgabe 4
Phasen des Waschvorgangs: 1. Benetzen, 2. Umnetzen, 3. Ablösen, 4. Dispergieren.
Die Waschwirkung der Tenside beruht darauf, dass sie grenzflächenaktive Stoffe sind. Aufgrund ihrer amphiphilen Struktur (polarer / hydrophiler Teil und unpolarer / lipophiler Teil) besetzen Tensidmoleküle die Grenzflächen zwischen zwei nicht mischbaren Phasen, z.B. aus Wasser und unpolarem Schmutz. Je mehr Tensidmoleküle sich an den Schmutz anlagern, desto stärker stoßen sich die hydrophilen Teile untereinander ab und es kommt zu einem Aufbrechen der Schmutzschicht und einer Abspaltung des Schmutzes von der Faser. Dadurch können weitere Tensidmoleküle an den Schmutz und die Faser gelangen und diese benetzen. Die Wechselwirkung der Seifenmoleküle führt zu einer starken Abstoßung von Schmutz und Faser und somit zur Ablösung des Schmutzes. Der abgelöste Schmutz wird durch die Anlagerung weiterer Tensidmoleküle dispergiert und somit
leichter vom Waschwasser fortgetragen.
Aufgabe 5
a Wasser besitzt eine hohe Oberflächenspannung. Sie entsteht durch die starken Anziehungskräfte aufgrund der Wasserstoffbrücken zwischen den Wassermolekülen und führt dazu, dass sich eine Art „Haut“ zwischen der Wasseroberfläche und der angrenzenden Phase (Luft) bildet. Tiere wie der Wasserläufer mit einer großen Auflagefläche der Beine bei geringem Gewicht können deshalb auf dem Wasser laufen, ohne unterzugehen.
b Nach Zugabe von Seife, einem anionischen Tensid, bildet sich an der Oberfläche der Lösung eine monomolekulare Seifenschicht aus. Dabei orientieren sich die Seifen-Anionen so, dass der hydrophile Teil in die wässrige Lösung weist und der hydrophobe Teil herausragt. Durch die Seifen-Anionen wird der Zusammenhalt der Wassermoleküle an der Oberfläche geschwächt: Seife verringert die Oberflächenspannung des Wassers und der Wasserläufer geht unter.
Aufgabe 6
a Tensid oben [Natriumdodecylsulfat]: Anionisches Tensid (dissoziiert in wässriger Lösung in negativ geladene Tensid-Anionen und Natrium-Kationen). Verwendung in Waschmitteln, Shampoos und Schaumbädern.
Tensid Mitte [Polyoxyethylen(6)laurylether]: Nichtionisches Tensid (dissoziiert nicht in wässriger Lösung, besitzt polare Glykolbausteine im Molekül). Verwendung in Flüssigwaschmitteln, Shampoos und Schaumbädern.
Tensid unten [Dodecyl-N,N-dimethylbenzylammoniumchlorid]: Kationisches Tensid (dissoziiert in wässriger Lösung in positiv geladene Tensid-Kationen und Chlorid-Anionen). Verwendung in Weichspülern.
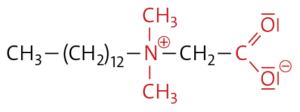
b Zwitterionische Tenside, z. B.:
Aufgabe 7
a In hartem Wasser sind hohe Konzentrationen an Calcium- und Magnesium-Ionen enthalten.
b Seife, aber auch alle anderen anionischen Tenside bilden mit Calcium- und Magnesium-Ionen schwerlösliche Salze („Kalkseifen“), die sich auf der Wäsche ablagern. Nur durch weiteren Zusatz an Tensiden liegen im Waschwasser ausreichend viele freie Tensid-Anionen vor, die die Waschwirkung bewirken. Deshalb kommt es in hartem Wasser zu einem Mehrverbrauch an Tensiden.
c Verwendung von Enthärtern wie Zeolithen, die Magnesium und Calcium-Ionen abfangen und somit die Bildung von Kalkseifen unterbinden. Sie sind in den meisten Waschmitteln bereits enthalten, können aber auch als separates Produkt zum Waschmittel dazugegeben werden.
Ersatz der anionischen Tenside durch nichtionische Tenside, die keine Kalkseifen bilden. Sie sind in vielen Waschmitteln enthalten. Diese Waschmittel sind jedoch teurer als solche mit anionischen Tensiden.
Aufgabe 8
a Längere Zeit getragene Kleidung weist Verschmutzungen aus Hautfetten auf. Natriumcarbonat reagiert in Wasser alkalisch:
CO32− + H2O HCO3− + OH−
Durch die OH−-Ionen kommt es zu einer alkalischen Spaltung des Fetts (Verseifung):
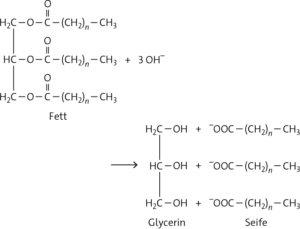
Aus dem in der Verschmutzung enthaltenen Fett wird Seife gebildet, die zur Waschwirkung und Schaumbildung führt. Um auf diese Weise waschen zu können, muss viel Fett vorhanden sein, um genügend Seife zu produzieren.
b Die Waschlauge ist stark alkalisch, außerdem erfordert die Bildung der Seife relativ viel Zeit. Textilien aus tierischen Fasern wie Wolle und Seide bestehen aus Proteinen, die durch alkalische Lösungen denaturiert werden (Zerstörung der molekularen Proteinstruktur). Es kommt zum Verfilzen der Wolle und Hartwerden des Seidenstoffs.
Aufgabe 9
a C6H12O6 + CH3–(CH2)15–OH ⟶ C6H11O5–O–(CH2)15–CH3 + H2O
Glucose + Hexadecan-1-ol ⟶ Hexadecylglycosid + Wasser
Es entsteht ein Alkylglycosid (nichtionisches Tensid).
b Das Alkyglycosidmolekül besitzt einen Glucosebaustein als hydrophile Gruppe (vier OH-Gruppen) und einen Hexadecylrest als lipophile Gruppe. Damit besitzt es die notwendigen Merkmale für ein nichtionisches Tensid.
c Mehrere Lösungen möglich, z. B.: Ausfällen von Kalkseifen mit hartem Wasser bei Seifen. (Alkylglycosid reagiert nicht mit den Calcium- und Magnesium-Ionen.) Messung des pH-Werts: Alkylglycoside reagieren als nichtionische Tenside pH-neutral. Messung der optischen Aktivität: Glucose ist optisch aktiv.
_____________________________________________
Seite 123
linke Spalte – Tenside in der Küche
Aufgabe 1
a
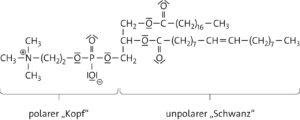
b Das Lecithinmolekül besitzt entsprechend dem „Kopf-Schwanz-Modell “ einen polaren, hydrophilen „Kopf“, der sich in die polare Essiglösung orientiert und einem unpolaren, hydrophoben „Schwanz“, der in das unpolare Öl ragt. Aufgrund dieser Struktur besetzen Lecithinmoleküle die Grenzfläche zwischen wässriger Essiglösung und dem Öl.
Aufgabe 2
a Das gegebene Rezept soll ohne das Eigelb umgesetzt werden. Entsteht aus dem verrührten Essig, Salz und Öl eine stabile Emulsion, d. h., sie trennt sich nicht nach kurzer Zeit in zwei Phasen auf, so werden die im Eigelb enthaltenen Stoffe für die Emulsion nicht benötigt.
Trennt sich die Essig-Salz-Öl-Mischung allerdings wieder auf, so könnte das Eigelb nachträglich unter die Mischung gerührt werden. Nun sollte eine stabilere Emulsion entstehen.
b Das Experiment zeigt, dass sich ohne Eigelb keine stabile Emulsion bildet. Sofort nach Beendigung des Rührens trennen sich die polare, wässrige Phase aus Essig und die unpolare Phase aus Öl wieder auf.
Bei einer späteren Zugabe von Eigelb ist die Bildung einer stabilen Emulsion erschwert, da die Zerteilung des Essigs in kleine Tröpfchen und die anschließende Verteilung der kleinsten Essigtröpfchen im Öl schwerer zu erreichen ist als bei der im Rezept angegebenen Vorgehensweise.
c Die emulgierende Wirkung lässt sich mithilfe des „Kopf-Schwanz-Modells“ erklären: Der polare, hydrophile „Kopf“ des Lecithinmoleküls ragt in die polare Essiglösung, wohingegen der unpolare, hydrophobe „Schwanz“ in das unpolare Öl weist und mit diesem wechselwirken kann. Damit vermittelt Lecithin zwischen den beiden eigentlich unmischbaren Phasen und verbindet sie.
Aufgabe 3
Salze von Fettsäuren lassen sich als Emulgatoren verwenden, denn die Fettsäure-Anionen besitzen wie das Lecithin einen polaren, negativ geladenen „Kopf“ (Carboxygruppe) und einen unpolaren „Schwanz“ Alkylgruppe) und wirken deshalb als grenzflächenaktiv zwischen der wässrigen Phase und der Fettphase. Außerdem sind sie ungiftig.
Nachteilig ist allerdings, dass in vielen Lebensmitteln auch Calcium- und/oder Magnesium-Ionen vorkommen. Mit diesen können Fettsäure-Anionen schwerlösliche Salze bilden, wodurch die Funktion des polaren „Kopfs“ und damit die emulgierende Wirkung verloren geht.
rechte Spalte – Seife vs. Duschgel
Aufgabe 1
a Von oben nach unten:
– Der Wollfaden ist mit Öl getränkt und wird in die Seifenlösung (Tensidlösung) eingebracht. Die Ölphase ist auf den Wollfaden begrenzt.
– Aufgrund der Wirkung des Tensids wird die Grenzflächenspannung zwischen Öl und wässriger Lösung verringert. Einige Tensidmoleküle besetzen die Grenzfläche indem ihre polaren „Köpfe“ in die wässrige Phase ragen, die unpolaren „Schwänze“ dagegen in die Ölphase. Die Ölphase beginnt sich vom Wollfaden abzulösen.
– Immer mehr Tensidmoleküle besetzen die Grenzfläche. Die Entmischung der Ölphase von der wässrigen Phase ist deutlich erkennbar.
– Die Grenzflächen sind vollständig von Tensidmolekülen besetzt. Die Entmischung beider Phasen erfolgt, wobei aufgrund der geringeren Dichte des Öls im Vergleich zu Wasser dieses nach oben fließt. Dabei wird die Oberfläche der Ölphase allmählich vergrößert und weitere Tensidmoleküle können sich an die Grenzfläche anlagern. Das Öl wird dabei dispergiert.
b Seifen sind die Alkalisalze von Fettsäuren und reagieren mit Wasser unter Bildung von alkalischen Lösungen. Diese reagieren Fasern tierischer Herkunft wie Wolle und Seide, die aus Proteinen aufgebaut sind. Die Moleküle von Proteinen besitzen Peptidbindungen die durch alkalische Hydrolyse gespalten werden. In alkalischer Seifenlösung kommt es also zur Zerstörung der Faserproteine, die Textilien verfilzen und werden hart und unbrauchbar.
Aufgabe 2
a
| Vergleich der Inhaltsstoffe von | ||
| Duschgel | Vollwaschmittel | Feinwaschmittel |
| flüssig: Wasser enthalten | pulverförmig oder fest verpresst, (Tabs): kein Wasser enthalten; dafür Stellmittel | flüssig: Wasser enthalten |
| Emulgator | – | Emulgator |
| anionische Tenside,
zwitterionische Tenside |
anionische Tenside,
nichtionische Tenside |
anionische Tenside,
nichtionische Tenside |
| Enthärter | – | Enthärter |
| Befeuchtungsmittel Glycerin | – | – |
| Konservierungsstoff Citronensäure | – | – |
| Duftstoffe | Duftstoffe | Duftstoffe |
| – | Enzyme | Enzyme |
| – | optische Aufheller | – |
| – | Vergrauungsinhibitoren | Vergrauungsinhibitoren |
| – | Schauminhibitoren | Schauminhibitoren |
| – | Korrosionsinhibitoren | Korrosionsinhibitoren |
Schlussfolgerungen:
– Vollwaschmittel sind pulverförmig oder zu Tabs gepresst und enthalten entsprechend kein Wasser und kein Befeuchtungsmittel, dafür jedoch Stellmittel, die das Waschpulver rieselfähig halten. Duschgel und flüssiges Feinwaschmittel ähneln sich in Bezug auf den Wasseranteil und die Emulgatoren, um eine stabile Tensidlösung zu gewährleisten.
– Anionische Tenside sind im Duschgel wie auch im Voll- und Feinwaschmittel enthalten. Wie bei den Waschmitteln sollten dies neutral reagierende anionische Tenside wie Fettalkoholsulfate und keine Seife sein, da eine alkalische Lösung die Haut schädigen würde. Zusätzlich enthält das Duschgel die teuren, aber besonders hautverträglichen zwitterionischen Tenside, z. B. Alkylbetaine. Waschmittel enthalten neben den anionischen Tensiden auch nichtionische Tenside, die keine der oben genannten Nachteile besitzen, aber in der Herstellung nicht ganz so teuer wie zwitterionische Tenside sind.
– Nur im Duschgel werden Konservierungsstoffe benötigt, denn beim Kontakt mit der Haut dürfen im Duschgel keine die Haut krankmachenden Keime enthalten sein. Dies ist bei den Waschmitteln nicht nötig, denn durch das Trocknen der Wäsche können sich evtl. vorhandene Keime nicht vermehren.
– Enzyme, optische Aufheller, Vergrauungsinhibitoren, Schauminhibitoren, Korrosionsinhibitoren sind typische Inhaltsstoffe von Waschmitteln, die auf den Erhalt der zu waschenden Textilien bzw. zum Schutz der Waschmaschine eingesetzt werden und finden deshalb im Duschgel keine Verwendung.
© Cornelsen Verlag GmbH