Lösungen zu Check-up
Kapitel 5 Organische Verbindungen
________________________________________________________
Seite 98 + 99
Stoffklassen
Aufgabe 1
a Methan: Vier Bindungen zwischen zentralem C-Atom und vier H-Atomen ⇒ tetraedrische Struktur. Geringe Elektronegativitätsdifferenz zwischen C- und H-Atom; das Molekül ist kein Dipol, da sich die Dipolmomente aufgrund der tetraedrische Struktur aufheben. Daher wirken nur schwache Van-der-Waals-Kräfte zwischen den Molekülen ⇨ niedrige Siedetemperatur.
Methylchlorid: Ein H-Atom des Methanmoleküls ist durch ein Chloratom ersetzt, die C–Cl-Bindung ist polar: ΔEN = 0,5. Das deutlich größere Chloratom benötigt mehr Raum als ein Wasserstoffatom. ⇨ Methylchlorid ist ein Dipol. Neben Van-der-Waals-Kräften treten auch Dipol-Dipol-Kräfte auf. ⇨ Daher ist die Siedetemperatur im Vergleich zu Methan aufgrund der stärkeren zwischenmolekularen Anziehungskräfte höher.
Hinweis: Chlor-Atome haben eine deutlich größere Masse als Wasserstoffatome ⇨ M(Methylchlorid) = 50,45 g · mol–1, M(Methan) = 16 g · mol–1. Die fast dreifach größere Molare Masse erhöht ebenfalls die Siedetemperatur des Methylchlorids im Vergleich zum Methan.
b Wasser: Zwei polare O–H-Bindungen, zwei freie Elektronenpaare am O-Atom, starker Dipol ⇨ zwischen den Wassermolekülen wirken Wasserstoffbrücken. Dies sind sehr starke zwischenmolekulare Kräfte (stärker als die bei Methylchlorid und viel stärker als die bei Methan wirkenden Kräfte). ⇨ Wasser hat die im Vergleich höchste Siedetemperatur.
Aufgabe 2
Wasser: aus Molekülen aufgebaut; bei Raumtemperatur flüssig, weil zwischen den Molekülen starke Wasserstoffbrücken wirken Schwefelwasserstoff: aus Molekülen aufgebaut, zwischen diesen Molekülen können sich keine Wasserstoffbrücken bilden. Deshalb ist Schwefelwasserstoff bei Raumtemperatur gasförmig.
Aufgabe 3
a CH4, C2H6: unpolare Moleküle; es wirken nur schwache Van-der-Waals-Kräfte
b HCl, HF: Moleküle mit polaren Elektronenpaarbindungen, ΔEN(HCl) = 0,9, ΔEN(HF) = 1,9; es wirken starke Wasserstoffbrücken zwischen den Molekülen
c CH3Cl, C2H5Cl: Moleküle mit polarer C–Cl Bindung; es wirken Dipol-Dipol-Kräfte, zudem schwache Van-der-Waals-Kräfte im Bereich der unpolaren Alkylgruppen
d Van-der-Waals-Kräfte < Dipol-Dipol-Kräfte < Wasserstoffbrücken
Aufgabe 4
a

b 4-Ethyl-2,3,8-trimethylnonan; 2,4,4-Trimethylhex-2-en; 2,2-Dibrom-1,3-dichlor-3-methylpentan
c Die IUPAC-Nomenklatur erlaubt Chemikerinnen und Chemikern weltweit effektiv zu kommunizieren. Die Nomenklatur hilft, Verwechslungen zu vermeiden: Verbindungen werden eindeutig benannt, sodass einem Namen genau eine Verbindung zugeordnet werden kann, was insbesondere im Umgang mit Gefahrstoffen auch sicherheitsrelevant ist. Durch die Systematik in der Nomenklatur kann auch ohne Kenntnis eines bestimmten Stoffes aus den Nomenklaturregeln auf die Strukturformel geschlossen werden. Aufgrund der teilweise recht sperrigen Namen ist die IUPAC-Nomenklatur möglicherweise nicht in allen Kontexten notwendig, insbesondere in informellen oder alltäglichen Situationen, kann eine vereinfachte Benennung ausreichend sein.
Aufgabe 5
a Das Funktionsprinzip der Gaschromatografie beruht auf den unterschiedlichen Wechselwirkungen der einzelnen Bestandteile des Gemisches mit der stationären Phase. Die stationäre Phase ist dabei eine dünne Schicht eines geeigneten Stoffes, die auf der Innenwand einer Säule aufgebracht ist. Die mobile Phase ist ein Gas, das durch die Säule strömt. Die Bestandteile des Gemisches werden unterschiedlich stark an der stationären Phase adsorbiert. Die Adsorption beruht auf intermolekularen Wechselwirkungen, insbesondere London-Kräften. Je größer die London-Kräfte sind, desto stärker werden die Stoffe zurückgehalten und desto langsamer wandern sie durch die Trennsäule. Die Bestandteile des Gemisches werden aufgrund dieser unterschiedlichen Adsorptionsfähigkeit unterschiedlich schnell von der mobilen Phase mitgeführt und dadurch voneinander getrennt. An einem Detektor werden die einzelnen Bestandteile des Gemisches erfasst und in einem Chromatogramm dargestellt. Die Retentionszeit, also die Zeit, die ein Bestandteil benötigt, um die Säule zu durchlaufen, ist bei gleichen Bedingungen immer gleich und kann deshalb zur Identifikation von Stoffen beispielsweise in Gemischen genutzt werden.
b Die Gaschromatografie ist ein wichtiges analytisches Verfahren in der Berufswelt, insbesondere in der chemischen Industrie und der Lebensmittelindustrie. Mit dieser Methode können Substanzen in einer Probe getrennt und identifiziert werden, was für die Qualitätssicherung und Produktentwicklung von großer Bedeutung ist.
Auch in der forensischen Analytik und der Umweltanalytik wird die Gaschromatografie eingesetzt. Insgesamt ist die Anwendung analytischer Verfahren in der Berufswelt unverzichtbar, um Produkte und Prozesse zu optimieren und gesetzliche Anforderungen zu erfüllen.
Aufgabe 6
| Alkane | Alkene | Alkine | |
| Beispiel | Ethan
CH3-CH3 |
Ethen
CH2=CH2 |
Ethin
CH≡CH |
| C-C-Bindung | Einfachbindung; jedes C-Atom hat genau 4 Bindungspartner; gesättigte KW* | Doppelbindung | Dreifachbindung |
| Die an diesen Bindungen beteiligten C-Atome haben weniger als 4 Bindungspartner: ungesättigte KW* | |||
| H-C-C-Bindungswinkel | 109,5 °C | 120 °C | 180 °C |
*KW = Kohlenwasserstoffverbindungen
- Geringe Elektronegativitätsdifferenz (ΔEN = 0,4) zwischen
H- und C-Atomen ⇨ die C–H-Bindung ist nur schwach polar.
Aufgrund der Molekülgeometrie fallen die positiven und
negativen
Teilladungen zusammen ⇨ die Moleküle sind keine
Dipole, die Verbindungen damit unpolar. - Zwischen den unpolaren Molekülen wirken als zwischenmolekulare
Kräfte nur London-Kräfte. - London-Kräfte steigen mit der Größe (Kettenlänge) der Moleküle
und deren molarer Masse ⇨ steigende Schmelz- und Siedetemperaturen
innerhalb der jeweiligen homologen Reihe
der Alkane, Alkene, Alkine. - Mit steigender Kettenlänge nimmt die Viskosität innerhalb
der homologen Reihen der Alkane, Alkene und Alkine zu. - Alkane, Alkene und Alkine sind untereinander in jedem
Mischungsverhältnis
löslich, ebenso in lipophilen Stoffen
wie Fetten. Die Löslichkeit beruht darauf, dass zwischen den
Molekülen ähnliche zwischenmolekulare Kräfte wirken. - Alkane sind allgemein reaktionsträge; typische Reaktionen:
Verbrennungen (Reaktion mit Sauerstoff) und Substitutionen
(z. B. radikalische Substitution mit Halogenen). - Alkene und Alkine sind wegen der hohen Elektronendichte an
den Mehrfachbindungen der Moleküle reaktionsfreudiger als
Alkane; typische Reaktion: Addition.
|
Kohlenwasserstoffe |
|||
| gesättigte |
ungesättigte |
||
|
Alkane |
Alkene
CnH2n |
Alkine CnH2n−2 |
|
| Kettenförmig
CnH2n+2 |
Ringförmig
CnH2n |
Doppelbindung |
Dreifachbindung |
|
Einfachbindung |
Einfachbindung |
||
Aufgabe 7
a
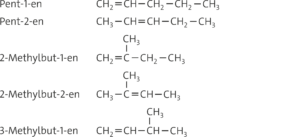
b Pent-2-en kann als cis- oder trans-Isomer vorliegen. Durch die π-Bindung ist die freie Drehbarkeit um die C=C-Bindungsachse bei Alkenen nicht mehr gegeben. Daher existieren zwei verschiedene Isomere: Bei Pent-2-en-Molekülen kann die Methylgruppe und die Ethylgruppe entweder auf der gleichen Seite oder an verschiedenen Seiten der Doppelbindung angeordnet sein.
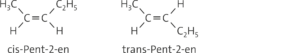
Aufgabe 8
Cis-trans-Isomere sind nicht dargestellt.

Aufgabe 9
Beim Sprühen bilden die gasförmigen bzw. leicht flüchtigen Alkane Luft-Gas-Gemische. Wenn der Anteil des Alkans in solch einer Mischung eine kritische Grenze überschreitet, sind diese Gemische explosiv. Der Sauerstoff in der Luft fördert die Verbrennung.
Dabei entstehen Kohlenstoffdioxid und Wasser:
2 C5H12(g) + 11 O2(g) ⟶ 10 CO2(g) + 12 H2O(g)
Da die Rektion sehr schnell verläuft und sich die Anzahl der Gasteilchen von 13 auf 22 erhöht, vergrößert sich das Volumen.
Dadurch kommt es zu einem explosionsartigen Verlauf der Reaktion
Aufgabe 10
Alkene addieren Brom unter Bildung von Dibromalkanen.
Bromierung von Propen:
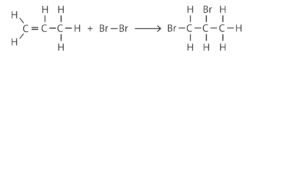
Vom Reaktionsprodukt 1,2-Dibrompropan existieren keine Isomere.
Bromierung von Buta-1-3-dien:
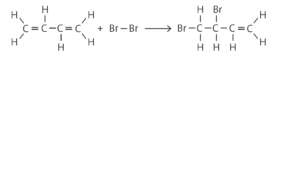
Vom Reaktionsprodukt 1,2-Dibrombut-3-en existieren keine Isomere, die Addition von Brom an der zweiten Doppelbindung führt zum gleichen Produkt. Es kann jedoch durch Addition von zwei Brommolekülen auch 1,2,3,4-Tetrabrombutan entstehen.
Aufgabe 11
a Die Hydroxygruppe (OH-Gruppe) bestimmt als funktionelle Gruppe der Alkohole Eigenschaften wie die Löslichkeit und die Schmelz- und Siedetemperaturen dieser Stoffgruppe. Die Eigenschaften werden zusätzlich durch die unterschiedlich langen Alkylgruppen beeinflusst. Bei kurzkettigen Alkoholen überwiegt der Einfluss der hydrophilen OH-Gruppe, deswegen sind Alkohole bis Butanol recht gut wasserlöslich. Je länger die Alkylgruppe ist, desto mehr überwiegt der hydrophobe Anteil und desto weniger wasserlöslich ist der entsprechende Alkohol.
Innerhalb der homologen Reihe der Alkohole nimmt die Löslichkeit in Wasser also ab, und die Löslichkeit in unpolaren Lösungsmitteln wie Benzin steigt an. Die Siedetemperaturen der Alkohole liegen deutlich über denen der Alkane mit vergleichbaren molaren Massen. Grund ist die Ausbildung von Wasserstoffbrücken zwischen den Alkoholmolekülen, was dazu führt, dass mehr Energie aufgewendet werden muss, um sie voneinander zu trennen, damit der Alkohol in einen anderen Aggregatzustand übergeht. Mit zunehmender Länge der Alkylgruppe nimmt auch die Siedetemperatur zu. Dies liegt wie bei den unpolaren Alkanen an den größer werdenden Van-der-Waals-Kräften.
b Zweiwertiger Alkohol: Zwei OH-Gruppen im Molekül gebunden;
sekundärer Alkohol: das C-Atom, an dem sich die OH-Gruppe befindet, ist mit zwei weiteren C-Atomen verbunden.
c Festes Natriumhydroxid (NaOH) besteht aus Ionenkristallen, die aus Na+– und OH–-Ionen aufgebaut sind. In Alkoholen ist die Hydroxygruppe über eine Elektronenpaarbindung an den Alkylrest des Moleküls gebunden. NaOH dissoziiert in Wasser in OH–-Ionen und Na+-Ionen, diese Lösung reagiert alkalisch.
Das ist bei der Lösung eines Alkohols in Wasser nicht zu beobachten.
Aufgabe 12
a primärer Alkohol: Butan-1-ol
b sekundärer Alkohol: Pentan-3-ol
c tertiärer Alkohol: 2-Methylpentan-2-ol
d zweiwertiger Alkohol: Pentan-2,4-diol
e primärer Alkohol: 3,3-Dimethylbutan-1-ol
f primärer Alkohol: 2-Methylbutan-1-ol
Aufgabe 13
2 CH3–CH2–CH2–CH2–OH + 2 K ⟶ 2 CH3–CH2–CH2–CH2–O– + 2 K+ + H2
Reaktionsprodukte: Kaliumbutanolat und Wasserstoff
Aufgabe 14
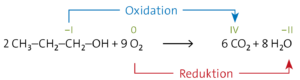
Aufgabe 15
Reaktion mit Butan-1-ol (es entsteht Butanal):
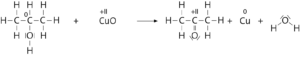
-I II I 0
CH3–CH2–CH2–CH2–OH + CuO ⟶ CH3–CH2–CH2–CHO + Cu + H2O
Reaktion mit Butan-2-ol (es entsteht Butanon):
0 II II 0
CH3–CH2–CH(–OH)–CH3 + CuO ⟶ CH3–CH2–CO–CH3 + Cu + H2O
Die Reaktion mit tert-Butanol ist nicht möglich, da am C-Atom, das die OH-Gruppe trägt, kein weiteres H-Atom gebunden ist, das abgespalten werden kann. Eine (partielle) Oxidation eines tertiären Alkohols ist deshalb nicht möglich.
Aufgabe 16
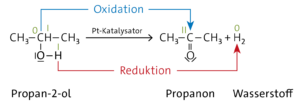
Aufgabe 17
a
| Alkohol A | Alkohol B | Alkohol C |
| CuO (schwarz) ↓ | CuO (schwarz) ↓ | CuO (schwarz) ↓ |
| Kupferblech wird wieder rot | Kupferblech wird wieder rot | Keine Veränderung
⇨ tert. Alkohol 3-Methyl-pentan-3-ol |
| Fehling-Probe ↓ | Fehling-Probe ↓ | |
| Positiv
⇨ Ethanol |
Negativ
⇨ Propan-2-ol |
b
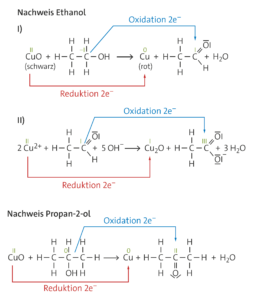
c
Organische Reaktionsprodukte bei der schrittweisen Oxidation von Ethanol:
I) Ethanal (Acetaldehyd); II) Acetat-Ion
Organisches Reaktionsprodukt bei der Oxidation von Propan-2-ol:
Propanon (Aceton)
Aufgabe 18
a Propanal
b Propanon
c But-2-enal
d 3-Hydroxypropanal
e 2,3-Dihydroxypropanal
f Pentandisäure (Glutarsäure)
Aufgabe 19
a I) Butandisäure (Bernsteinsäure); II) Methansäure (Ameisensäure); III) 2-Amino-3-hydroxypropansäure (Serin); IV) Heptadecansäure
b Butandisäure besitzt zwei pKS-Werte, da im Butandisäuremolekül zwei Säuregruppen enthalten sind. Das erste Proton lässt sich leichter abspalten als das zweite, da durch die negative Ladung an der zurückbleibenden Säuregruppe die Elektronendichte im Molekül erhöht und so die Polarisierung der O−H-Bindung in der gegenüberliegenden Säuregruppe verringert wird. Dadurch wird die Abspaltung des Protons aus der gegenüberliegenden Säuregruppe erschwert:
1. Protolysestufe: HOOC−CH2−CH2−COOH + H2O ⇄ HOOC−CH2−CH2−COO– + H3O+; pKS1 = 4,16
2. Protolysestufe: HOOC−CH2−CH2−COO– + H2O ⇄ –OOC−CH2−H2−COO– + H3O+; pKS2 = 5,61
Aufgabe 20
a Ethansäureethylester: Ethansäure, Ethanol
Propansäureethylester: Propansäure, Ethanol
Ethansäurepropylester: Ethansäure, Propan-1-ol
Methansäurehexylester: Methansäure, Hexan-1-ol
In allen Fällen wird Schwefelsäure als Katalysator eingesetzt.
b Namen nach IUPAC:
Ethansäureethylester: Ethylethanoat
Propansäureethylester: Ethylpropanoat
Ethansäurepropylester: Propylethanoat
Methansäurehexylester: Hexylmethanoat
Aufgabe 21
Ethansäurebutylester (Butylethanoat):
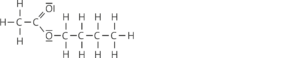
Aufgabe 22
a Propansäure (M = 74 g · mol–1) besitzt eine größere molare Masse als Propan-1-ol (M = 60 g · mol–1), wodurch die Dispersionskräfte und damit die benötigte Energie zur Überwindung dieser intermolekularen Anziehungskräfte größer ist. Des Weiteren bildet Propansäure stabile „Dimere“, wodurch die Dispersionskräfte weiter deutlich erhöht werden.
ϑ(CH3–CH2–COOH) > ϑ(CH3–CH2–CH2OH)
[ϑ(Propansäure) = 141 °C); ϑ(Propan-1-ol) = 97 °C]
b Pentansäure und 2,2-Dimethylpropansäure sind „stellungsisomere“ Verbindungen, wodurch der Siedetemperaturunterschied nur durch die unterschiedliche Oberflächenstruktur hervorgerufen wird. Die verzweigte 2,2-Dimethylpropansäure hat eine niedrigere Siedetemperatur, da hier die London-Kräfte aufgrund ihrer geringen Reichweite weniger wirksam sind. Demnach ist weniger Energie zur Überwindung der intermolekularen Anziehungskräfte nötig.
ϑ(Pentansäure) > ϑ(2,2-Dimethylpropansäure)
[ϑ(Pentansäure) = 187 °C); ϑ(2,2-Dimethylpropansäure) = 164 °C]
_____________________________________________________
Seite 100 + 101
Reaktionswege
Aufgabe 1
a Reaktionsmechanismus, der zu einem der drei isomeren Hauptprodukte (hier: 1-Brom-3-ethylpentan) führt:
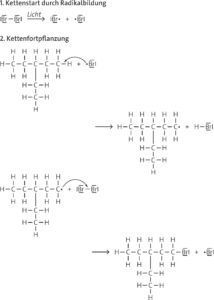
b 1-Brom-3-ethylpentan, 2-Brom-3-ethylpentan, 3-Brom-3-ethylpentan
c Das Wasser im angefeuchteten Indikatorpapier reagiert mit dem in der Reaktion entstandenen gasförmigen Bromwasserstoff:
HBr(g) + H2O(l) ⟶ H3O+(aq) + Br–(aq)
Die gebildeten Oxonium-Ionen führen zu einer Rotfärbung des Indikatorpapiers.
Aufgabe 2
Die vier C–Cl-Bindungen im Tetrachlormethanmolekül (CCl4) sind stark polar. Wegen der tetraedrischen Molekülgeometrie fallen die positiven und negativen Teilladungen zusammen, sodass CCl4-Moleküle insgesamt unpolar sind; zwischen ihnen wirken als zwischenmolekulare Kräfte nur Van-der-Waals-Kräfte. Fette bestehen aus unpolaren Molekülen. Es gilt: „Gleiches löst sich in Gleichem“ ⇨ gute Löslichkeit von Fett in Tetrachlormethan, aber keine Löslichkeit von Fett in Wasser (polare Moleküle).
Zwischen den polaren Wassermolekülen wirken auch Wasserstoffbrücken, also stärkere zwischenmolekulare Kräfte, als zwischen den unpolaren Fettmolekülen. Die Moleküle dringen nicht in den Molekülverband der jeweils anderen Sorte ein, da zwischen jeweils gleichartigen Molekülen insgesamt stärkere Kräfte wirken als zwischen verschiedenen Molekülen.
Aufgabe 3
a
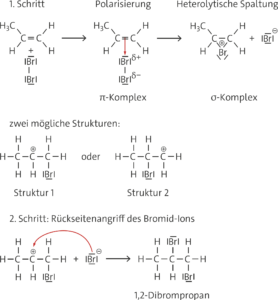
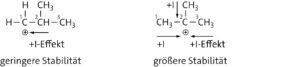
Struktur 1 ist stabiler als Struktur 2, da das sekundäre Carbenium-Ion durch + I-Effekte der Methylgruppen stabilisiert wird.
b Durch die Gegenwart von Lithiumchlorid sind Chlorid-Ionen im Reaktionsansatz vorhanden, die mit den Bromid-Ionen um die Addition an das sekundäre Bromonium-Ion (Struktur 1) konkurrieren. Nach Addition des Chlorid-Ions entsteht 1-Brom-2-chlorpropan. Würde das Chlorid-Ion an das primäre Bromonium-Ion (Struktur 2) addiert werden, würde formal auch 2-Brom-1-chlorpropan entstehen.
Aufgabe 4
a SN1-Reaktion:
C6H13–I + OH– ⟶ C6H13–OH + I–
Reaktionsprodukt: 2-Methylpentan-2-ol, (Natriumiodid)
b
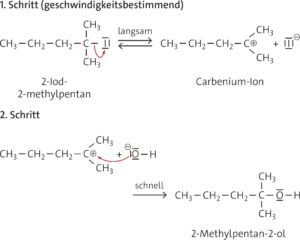
c
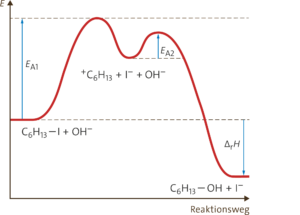
Aufgabe 5
Bei primären Halogenalkanen ist der nucleophile Angriff erleichtert, weil keine sterische Hinderung durch die Alkylgruppen vorliegt. Sie reagieren bevorzugt nach dem SN2-Mechanismus.
Aufgabe 6
Reaktionsmechanismus für die Addition von Propan-1-ol an Ethanal (nucleophile Addition):
Ethanal (nucleophile Addition):
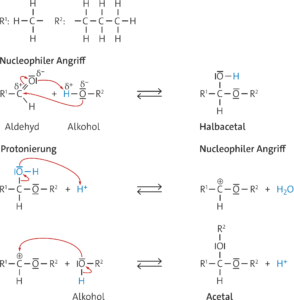
Hinweis: Das Produkt des ersten nucleophilen Angriffs ist ein Halbacetal, das Produkt des zweiten nucleophilen Angriffs ist ein Acetal.
Aufgabe 7
a Butansäuremethylester (Methylbutanoat)
b Säurekatalysierte Esterbildung:
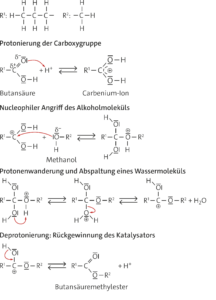
c Alkalische Hydrolyse (Verseifung):
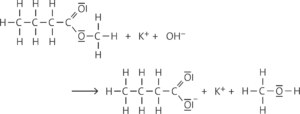
Aufgabe 8
a Ethansäureethylester: Ethansäure, Ethanol
Propansäureethylester: Propansäure, Ethanol
Ethansäurepropylester: Ethansäure, Propan-1-ol
Methansäurehexylester: Methansäure, Hexan-1-ol
In allen Fällen wird Schwefelsäure als Katalysator eingesetzt.
b Namen nach IUPAC:
Ethansäureethylester: Ethylethanoat
Propansäureethylester: Ethylpropanoat
Ethansäurepropylester: Propylethanoat
Methansäurehexylester: Hexylmethanoat
Aufgabe 9
An das doppelt gebundene Sauerstoffatom der Estergruppe wird ein Proton angelagert (Protolyse). Das entstandene Kation addiert ein nucleophiles Wassermolekül. Durch intramolekulare Protolyse wird ein Proton auf das Brückensauerstoffatom übertragen.
Dann wird ein Alkoholmolekül eliminiert. Zurück bleibt ein protoniertes Säuremolekül, das sich durch Abgabe eines Protons stabilisiert. Der Katalysator ist somit zurückgebildet. Da das Proton an irgendein Teilchen übergeben werden muss (hier vermutlich ein Wassermolekül), kann man hier auch von einer Protolyse sprechen. Insgesamt folgt einer nucleophilen Addition eine Eliminierung. Man kann allerdings die Reaktion auch als nucleophile Substitution einer Alkoholatgruppe durch eine Hydroxidgruppe auffassen.
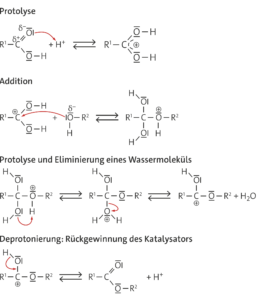
Aufgabe 10
Beim Chlorethen ist gegenüber dem Ethenmolekül ein Wasserstoffatom durch ein Chloratom ersetzt. Aufgrund der höheren Elektronegativität des Chloratoms übt dieses einen −I-Effekt aus, was dazu führt, dass die Elektronendichte am benachbarten Kohlenstoffatom und damit an der C=C-Doppelbindung erniedrigt wird. Ein elektrophiler Angriff an die Doppelbindung ist demnach erschwert, weshalb die Addition von Brom an Chlorethen langsamer verläuft als die an Ethen. Je mehr Wasserstoffatome durch Chloratome ersetzt werden, desto geringer ist die Elektronendichte an der C=C-Doppelbindung und desto langsamer verläuft die Addition von Brom.
Aufgabe 11
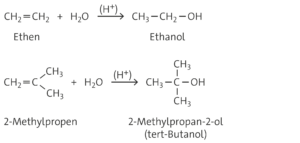
Aufgabe 12
Die elektrophile Addition lässt sich in zwei Teilschritte gliedern:
die Bildung des positiv elektrisch geladenen Carbenium-Ions und die Entstehung des Endprodukts durch einen nucleophilen Angriff am Carbenium-Ion.
Im Bromwasser konkurrieren die entstandenen Bromid-Ionen und die mengenmäßig überwiegenden Wassermoleküle als nucleophile Teilchen miteinander, sodass durch Bindung eines Wassermoleküls über eines der freien Elektronenpaare am Sauerstoffatom und nachfolgender Abspaltung eines Protons vorwiegend 2-Bromethanol anstelle von 1,2-Dibromethan entsteht. Würde man z. B. durch Zugabe eines Salzes die Bromid-Ionen-Konzentration erhöhen, so würde man die Bildung von 1,2-Dibromethan begünstigen.
Aufgabe 13
CH3–CH2–CH2Br + K+ + OH– \( \rightleftharpoons \) CH3–CH2–CH2Br + K+ + Br–
Diese Reaktion läuft bevorzugt nach dem SN2-Mechanismus ab, da die Abgangsgruppe (– Br) an ein primäres Kohlenstoffatom gebunden ist. Dadurch kann die Abspaltung dieser Abgangsgruppe und der Angriff des Nucleophils (OH–) gleichzeitig erfolgen.
Aufgabe 14
Das nucleophile Hydroxid-Ion wird im ersten Reaktionsschritt an das positivierte Kohlenstoffatom der Estergruppe addiert. Anschließend wird ein Alkoholat-Ion eliminiert. Das Alkoholat-Ion, eine starke Brönsted-Base, nimmt von dem zurückbleibenden Säuremolekül ein Proton auf. Diese Protolyse ist irreversibel, weil das Säuremolekül eine sehr viel stärkere Brönsted-Säure als das gebildete Alkoholmolekül ist.
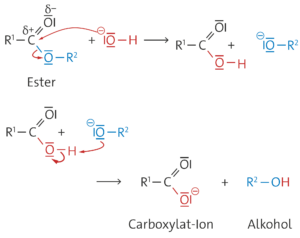
Aufgabe 15
a Reaktion & Reaktionstyp:
R1: (Thermisches) Cracken
R2: Elektrophile Addition von Chlor
R3: Eliminierung von Chlorwasserstoff
R4: Elektrophile Addition von Wasser
R5: Eliminierung von Wasser (Dehydratisierung)
R6: Elektrophile Addition von Bromwasserstoff
R7: Eliminierung von Bromwasserstoff
b Im Folgenden werden nur die wesentlichen Schritte der Mechanismen angegeben.
R3 (Eliminierung von Chlorwasserstoff):
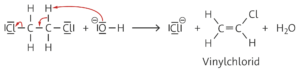
R4 (Elektrophile Addition von Wasser):
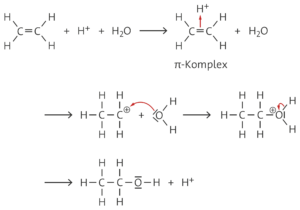
R6 (Elektrophile Addition von Bromwasserstoff):
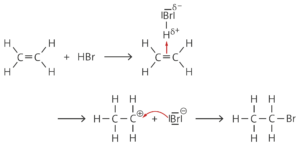
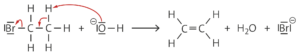
R7 (Eliminierung von Bromwasserstoff):
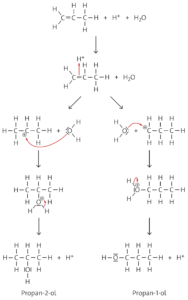
c Die Addition von Wasser an Propen gelingt nur bei Anwesenheit einer Säure, die die für den ersten Schritt notwendigen Protonen liefert. Das Proton lagert sich dabei am wasserstoffreicheren Ende der Doppelbindung an, da das sekundäre Carbenium-Ion stabiler als das primäre ist (Regel von Markownikow). Dies liegt an dem +I-Effekt der jeweils benachbarten Methylgruppen. Daher entsteht bevorzugt 2-Propanol.
Aufgabe 16
a
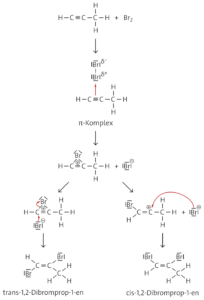
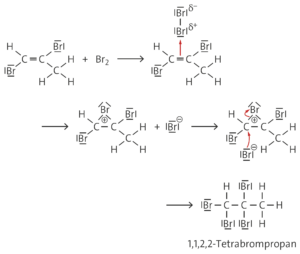
Ebenso wie bei der elektrophilen Addition von Brom an Alkene bildet sich auch an der Dreifachbindung von Alkinen wie dem Propin ein π-Komplex aus. Dabei wird das elektrophile Bromid-Ion an das wasserstoffreichere Kohlenstoffatom addiert, da so das energetisch günstigere sekundäre Carbenium-Ion entsteht. Nach Addition des Bromid-Ions entstehen cis-1,2-Dibromprop-1-en und trans-1,2-Dibromprop-1-en, wobei letzteres aus sterischen Gründen energetisch begünstigt ist und mengenmäßig überwiegt. Es liegt cis-trans-Isomerie vor, da die freie Drehbarkeit um die C=C-Bindungsachse nicht gegeben ist. Durch Addition eines zweiten Brommoleküls entsteht 1,1,2,2-Tetrabrompropan. Hier lassen sich verschiedene Konformationsisomere formulieren, die durch Drehung um die Einfachbindungen ineinander umwandelbar sind.
b Das Bromchloridmolekül ist ein polares Molekül. Aufgrund der höheren Elektronegativität des Chloratoms liegt die positive Partialladung beim Bromatom. Bei der heterolytischen Spaltung nach Annäherung an die Dreifachbindung wird das positiv geladene Brom-Ion zuerst am wasserstoffreicheren Ende des But-1-inmoleküls gebunden, da das sekundäre Carbenium-Ion stabiler ist. Das negativ geladene Chlorid-Ion lagert sich dann an das zweite Kohlenstoffatom an, sodass vorwiegend 1-Brom-2-chlorbut-1-en entsteht. Aus sterischen Gründen bildet sich hauptsächlich das energetisch günstigere trans-Isomer: trans-1-Brom-2-chlorbut-1-en.
Aufgabe 17
Prinzipiell wären bei dieser Reaktion drei verschiedene Isomere als Reaktionsprodukt der Reaktion von 3-Ethylpentan mit Brom in einer radikalischen Substitution möglich: 1-Brom-3-ethylpentan, 2-Brom-3-ethylpentan und 3-Brom-3-ethylpentan. Dass 3-Brom-3-ethylpentan mengenmäßig überwiegt liegt daran, dass das tertiäre Alkylradikal durch den +I-Effekt der drei Ethylgruppen im Vergleich zum primären oder sekundären Alkylradikal besser stabilisiert und daher energetisch begünstigt ist.
Aufgabe 18
a Die Reaktion von A und B mit Fehling’scher Lösung zeigt das Vorhandensein einer Aldehydgruppe im Molekül an. Die Reaktion von C und D mit Natrium kann durch eine Hydroxygruppe im Molekül ermöglicht werden. Die Entfärbung von Bromwasser zeigt eine Mehrfachbindung in C und D an.
A Butanal
B 2-Methylpropanal
C But-2-en-2-ol
D But-3-en-1-ol
b CH3–CH2–CH2–CHO + 2 Cu2+ + 5 OH– ⟶ CH3–CH2–CH2–COO– + Cu2O↓ + 3 H2O
2 CH2=CH–CH2–CH2–OH + 2 Na ⟶ 2 CH2=CH–CH2–CH2–O– + 2 Na+ + H2↑
CH2=CH–CH2–CH2–OH + Br2 ⟶ CH2Br–CHBr–CH2–CH2–OH
c
H3C–CH2–CH=CH–OH But-1-en-1-ol
H2C =CH–CH–CH3 But-3-en-2-ol
xxxxxxxxxx│
xxxxxxxxxxOH
H2C =C– CH2– CH3 But-1-en-2-ol
xxxxxx│
xxxxxxOH
H2C =C– CH2 –OH 2-Methylprop-2-en-1-ol
xxxxxx│
xxxxxxCH3
______________________________________________
Seite 102
Addition von Brom an ungesättigte Kohlenwasserstoffe
Aufgabe 1
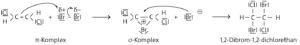
Aufgabe 2
Der geschwindigkeitsbestimmende Schritt bei der elektrophilen Addition von Brom an ein Alken ist die Reaktion des Elektrophils, d. h. des polarisierten Brommoleküls, mit dem jeweiligen Alken. Alle Faktoren, welche die Elektronendichte der Doppelbindung verändern, haben daher einen Einfluss auf die Reaktionsgeschwindigkeit.
Vergleicht man Hex-1-en mit 1,2-Dichlorethen, so ist die Elektronendichte aufgrund des −I-Effekts der Chloratome gegenüber der des Hexens sehr viel geringer. Als Konsequenz daraus ist auch die Reaktionsgeschwindigkeit herabgesetzt bzw. es findet keine Reaktion mehr statt.
Beim Cyclohexen wird die Reaktionsgeschwindigkeit durch die sterischen Effekte aufgrund der Behinderung durch die Ringstruktur etwas erniedrigt.
Alkylgruppen mit einem +I-Effekt erhöhen hingegen die Reaktionsgeschwindigkeit, da sie die Elektronendichte der Doppelbindung verstärken.
Ethanol ist ein polares Lösemittel und kann die Polarisierung des Brommoleküls stabilisieren, was einen reaktionsbegünstigenden Effekt zur Folge hat. Dieser Effekt unterbleibt beim unpolaren Tetrachlormethan.
Aufgabe 3
Konfigurationsisomere sind nur durch Brechen und Neuknüpfen von Bindungen ineinander umwandelbar. Durch die Ausbildung der π-Bindung ist bei den Alkenen die freie Drehbarkeit um die Kohlenstoff-Kohlenstoff-Bindungsachse wie bei den Alkanen nicht mehr gegeben. Daher existieren zwei verschiedene Isomere des 1,2-Dichlorethens. Einmal können sich die beiden Substituenten auf derselben Seite der Doppelbindung, also in cis-Stellung befinden, im anderen Fall liegen sich die Substituenten gegenüber, was als trans-Stellung bezeichnet wird.
Aufgabe 4
Bromethen reagiert etwa 30-mal langsamer als Ethen. Aufgrund der höheren Elektronegativität des Bromatoms verringert sich die Elektronendichte an der Kohlenstoff-Kohlenstoff- Doppelbindung. Das Kohlenstoffatom hat eine positive Partialladung, das Bromatom eine negative. Dieser elektronenziehende Effekt wirkt sich auch auf die Doppelbindung aus, deren Elektronendichte geringer wird. Ein elektrophiler Angriff ist somit erschwert. Umgekehrt verlaufen elektrophile Additionen erheblich schneller, wenn die zweifach gebundenen Kohlenstoffatome Alkylgruppen tragen. Die Addition von Brom an Propen verläuft etwa 100-mal schneller als die an Ethen. Alkylgruppen besitzen einen elektronenschiebenden Effekt und erhöhen somit die Elektronendichte an der Kohlenstoff-Kohlenstoff- Doppelbindung. Der elektrophile Angriff ist erleichtert. Daher ist die Reaktionsgeschwindigkeit von 2,3-Dimethylbut-2-en vergleichsweise am höchsten.
Aufgabe 5

______________________________________________
Seite 103
linke Spalte – Alkohole unter der Lupe
Aufgabe 1
Die Härchen (Spatulae) an der Unterseite der Füße des Geckos können aufgrund ihrer sehr geringen Größe von 200 nm (1 nm = 10–9 m) über Van-der-Waals-Kräfte in Wechselwirkung mit Oberflächen wie Glas treten. Durch die enorm große Anzahl der Härchen ergibt sich in der Summe eine hinreichend große Anziehungskraft, um den Gecko an der Wand festzuhalten.
Aufgabe 2
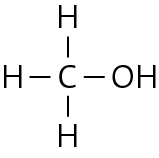
a Methanol:
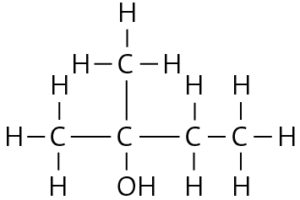
2-Methyl-butan-2-ol:
Pentan-2-ol:
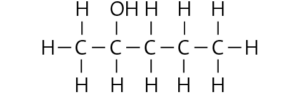
Pentan-3-ol:
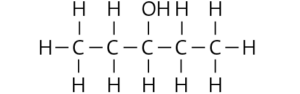
Hexan-3-ol:
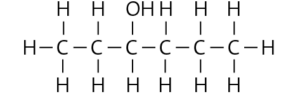
Pentan-1,2-diol:
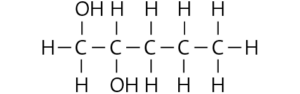
b Die Siedetemperatur der Stoffe wird von ihrer molaren Masse und den wirkenden zwischenmolekularen Kräften bestimmt. Es gilt: Je größer die molare Masse und/oder die zwischenmolekularen Kräfte eines Stoffs, desto höher ist seine Siedetemperatur. Die Löslichkeit eines Stoffs in Wasser wird von der Polarität seiner Moleküle und ihrer Fähigkeit bestimmt, Wasserstoffbrücken zu den Wasser- molekülen auszubilden.
| Alkohol | Siedetemperatur | Löslichkeit in Wasser |
| Methanol | geringste molare Masse, im Vergleich zu den anderen Alkoholmolekülen kleinste Alkylgruppe
⇒ geringe Van-der- Waals-Kräfte ⇒ geringste Siedetemperatur aller aufgeführten Alkohole |
im Vergleich zum unpolaren und wasserunlöslichen Methan ist das Methanolmolekül aufgrund der OH- Gruppe polar
⇒ Methanol ist vollständig in Wasser löslich |
| 2-Methylbutan-2-ol, Pentan-2-ol und Pentan-3-ol sind Strukturisomere; bei Strukturisomeren mit gleichen molaren Massen hängen Unterschiede in Siedetemperatur und
Löslichkeit nur von den zwischenmolekularen Kräften ab: |
||
| 2-Methylbutan-2-ol | innerhalb der Strukturisomere hat das | Die drei Strukturisomere sind – im Vergleich |
| Alkohol | Siedetemperatur | Löslichkeit in Wasser |
| Pentan-2-ol
Pentan-3-ol
|
2-Methylbutan-2-ol- Molekül den höchsten Verzweigungs- grad ⇒ geringste Van-der-Waals-Kräfte ⇒ die geringste Siedetemperatur; bei den unverzweigten Pentan-2-ol- und Pentan-3-ol ist die Siedetemperatur annähernd gleich | zu Hexan-3-ol – insgesamt gut löslich in Wasser.
Hinweis: Die bessere Löslichkeit von Pentan- 2-ol trotz längerem Alkylrest als 2-Methylbutan-2-ol ist nur mit sterischen Effekten erklärbar und wird nicht als Lösung erwartet
|
| Hexan-3-ol | Siedetemperatur liegt aufgrund größerer molarer Masse (größeren Van-der-Waals-Kräften) höher als bei den Strukturisomeren und bei Methanol | kaum löslich in Wasser wegen der im Vergleich zu den Strukturisomeren und Methanol langen Alkylgruppe |
| Pentan-1,2-diol |
ähnliche molare Masse wie Hexan-3-ol; die beiden polaren OH-Gruppen im Molekül ermöglichen jedoch die Ausbildung von mehreren Wasserstoffbrücken ⇒ höchste Siedetemperatur aller aufgeführten Alkohole
|
vollständig in Wasser löslich, da die beiden OH-Gruppen die Ausbildung von zwei Wasserstoffbrücken zu Wassermolekülen ermöglicht; dieser Effekt überwiegt den negativen Effekt der relativ langen unpolaren Alkylgruppe |
c Die Van-der-Waals-Kräfte sind für den Gecko entscheidend für die „Haftung“ auf dem Glas. Nur durch diese Wechselwirkungskräfte ist die Anziehung zwischen Gecko und Glasoberfläche begründet. Je mehr Härchen der Fußunterseite Van-der-Wals-Kräfte zum Glas ausbilden, desto stärker ist die Anziehung zwischen Gecko und Glas. Van-der-Waals-Kräfte sind ebenso entscheidend für die Wechselwirkung der unpolaren Molekülbereiche von Alkoholmolekülen. Je größer die Moleküloberfläche, desto stärker in der Summe der Van-der-Wals-Kräfte und damit die Stärke der Anziehung zwischen den Alkoholmolekülen.
Aufgabe 3
Pentan-2-ol eignet sich sowohl als Lösungsmittel für das polare Ethanol als auch für das unpolare Hexan. Das Pentan-2-ol-Molekül kann einerseits mit der polaren Hydroxygruppe am C-2-Atom Wasserstoffbrücken zur polaren Hydroxygruppe der Ethanolmoleküle ausbilden. Andererseits ist der unpolare Alkylrest mit drei C-Atomen immer noch groß genug, um in Wechselwirkung mit dem unpolaren Hexanmolekülen zu treten, sodass Van-der-Waals-Kräfte zwischen Pentan-2-ol und Hexan wirken. Das Pentan-2-ol-Moleküle besitzt also Strukturmerkmale, die es als Lösungsmittel für polare und unpolare Stoffe in Frage kommen lässt.
Aufgabe 4
a
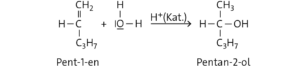
b Die OH-Gruppe könnte auch am ersten Kohlenstoffatom addiert werden. Dann erhielte man Pentan-1-ol als Produkt.
Auch der Katalysator selbst könnte reagieren. Dann entstünde 1-Chlorpentan oder 2-Chlorpentan.
rechte Spalte – Ähnlich, aber doch verschieden
Aufgabe 1
a
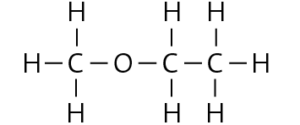
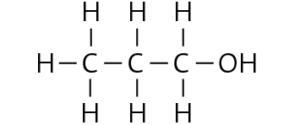
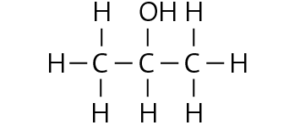
b Mehrere Lösungen möglich, z. B.:
– Die beiden Alkanole Propan-1-ol und Propan-2-ol lösen sich in Wasser, der Ether dagegen nicht. Durch Zugabe von beispielsweise 1 ml des jeweiligen Stoffs zu einigen Millilitern Wasser kann die Löslichkeit überprüft werden. Ist der Stoff in Wasser löslich, muss es einer der beiden Alkohole sein, andernfalls liegt der Ether vor.
– Zur Unterscheidung der beiden Alkohole könnte man beispielsweise die Siedetemperatur bestimmen, indem man eine Probe jeweils in ein Reagenzglas gibt, diese in einem Wasserbad erhitzt und die Temperatur beim Sieden ermittelt.
Hinweis: Man kann auch die Lucas-Probe durchführen. Das Lucas-Reagenz (Zinkchlorid in konz. Salzsäure) führt zu einer Substitution der OH-Gruppe durch ein Chlorid-Ion. Man gibt einige Tropfen des zu testenden Alkohols in das Lucas-Reagenz. Wenn sich eine milchig trübe Lösung bildet, ist der Test positiv. Dabei reagieren sekundäre Alkohole nach kurzer Zeit (innerhalb von 5 min), primäre Alkohole jedoch nur nach vorsichtigem Erwärmen. Die Trübung beruht auf der Bildung des chlorierten Kohlenwasserstoffs, der sich deutlich schlechter im Reagenz löst als der stark polare Alkohol.
Aufgabe 2
Ethanol reagiert mit dem Alkalimetall Natrium unter Bildung von Wasserstoff, Natrium- und Ethanolat-Ionen in Analogie zur Reaktion von Wasser mit Natrium unter Bildung von Wasserstoff und Natronlauge. Natrium wird oxidiert, wobei das Elektron vom stark positiv polarisierten Wasserstoffatom der OH-Gruppe aufgenommen wird, das dadurch reduziert wird:
2 CH3–CH2–OH + 2 Na → H2 + 2 CH3–CH2–O– + 2 Na+
Hinweis: Auf die gleiche Weise reagiert Kalium mit Ethanol:
2 CH3–CH2–OH + 2 K → H2 + 2 CH3–CH2–O– + 2 K+
Aufgabe 3
Es erfolgt eine Substitutionsreaktion, bei der das Ethanolat-Ion das Bromid-Ion im Brommethanmolekül ersetzt:
CH3–CH2–O– + CH3–Br → CH3–CH2–O–CH3 + Br–
Wenn man Propan-2-ol anstelle des Ethanols verwendet, ist die analoge Reaktion zu erwarten. Mit Natrium bilden sich Propan-2-olat-Anionen, die mit Brommethan den Ether 2-Methoxypropan bilden:
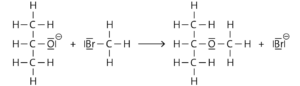
Aufgabe 4
a Eine Kondensation ist eine Reaktion, bei der ein kleines, stabiles Molekül abgespalten wird. Hier ist es das Wassermolekül:
CH3–CH2–OH + CH3–OH → CH3–CH2–O–CH3 + H2O
b Es liegen im Reaktionsansatz die Ausgangsstoffe Ethanol und Methanol im Gemisch vor. Deshalb können sowohl
– Ethanol- und Methanolmoleküle unter Bildung von Methylethylethermolekülen
– Ethanol- und Ethanolmoleküle unter Bildung von Diethylethermolekülen
– Methanol- und Methanolmoleküle unter Bildung von Dimethylethermolekülen reagieren.
Daher liegt im Produkt ein Gemisch aus Methylethylether, Diethylether und Dimethylether vor.
Aufgabe 5
Das Diethylethermolekül besitzt ein Sauerstoffatom, das als „Brücke“ zwischen den beiden Ethylgruppen eingebaut ist. Das Molekül weist zwar ein partiell negativ polarisiertes Sauerstoffatom auf, es fehlt jedoch – anders als bei Alkoholmolekülen – ein an das Sauerstoffatom gebundenes Wasserstoffatom. Deshalb können Ethermoleküle untereinander keine Wasserstoffbrücken ausbilden, es wirken nur Van-der-Waals-Kräfte. Auch zwischen Pentanmolekülen wirken nur die im Vergleich zu den Wasserstoffbrücken wesentlich schwächeren Van-der-Waals-Kräfte. Die zwischenmolekularen Anziehungskräfte von Diethylether und Pentan sind deshalb vergleichbar stark, woraus auch ähnliche Siedetemperaturen resultieren (Diethylether: 34,5 °C, Pentan: 36 °C).
Beim Lösen in Wasser spielt die partiell negative Ladung des Sauerstoffatoms im Diethylethermolekül die entscheidende Rolle. An dieser Stelle können sich Wasserstoffbrücken zu Wassermolekülen ausbilden. Daher löst sich Diethylether besser in Wasser als Pentan, wenn auch nicht ganz so gut wie Butan-1-ol, dass über die OH-Gruppe auch selbst zu Sauerstoffatomen des Wassermoleküls Wasserstoffbrücken aufbauen kann. Da der unpolare Anteil des Diethylethermoleküls mit je zwei Ethylgruppen jedoch recht groß ist, ist die Löslichkeit insgesamt geringer als bei Propanol.
______________________________________________
Seite 104
Oxidationsprodukte des Propanols im Vergleich
Aufgabe 1
Propan-1-ol:

Propan-2-ol:

Aufgabe 2
Abbildung 1: Das Drahtnetz verfärbt sich jeweils von rötlich metallisch glänzend zu schwarz.
Abbildung 2: In beiden Fällen beobachtet man jeweils eine Rotfärbung des Netzes.
Abbildung 3: In beiden Fällen beobachtet man eine Blaufärbung des Watesmo-Papiers.
Aufgabe 3
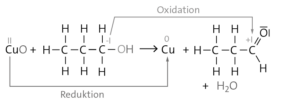
Abbildung 1: Es findet eine oberflächliche Oxidation des Kupfers zu Kupfer-(II)-oxid statt.
Abbildung 2: Es findet eine Reduktion von Kupferoxid sowie eine Oxidation von Propan-1-ol zu Propanal bzw. von Propan-2-ol zu Propanon statt.
Abbildung 3: In beiden Fällen wird die Bildung von Wasser nachgewiesen.
Aufgabe 4
Eine chemische Reaktion ist immer mit einer Veränderung der Stoffeigenschaften verbunden. Durch das Besprühen der erhitzten Kupferdrähte mit Propan-1-ol bzw. propan-2-ol entsteht aus dem schwarzen Draht ein hochglänzender Draht. Das Kupfer-(II)-oxid wird zu elementarem Kupfer reduziert. Weiterhin findet eine Oxidation von Propan-1-ol zu Propanal bzw. von Propan-2-ol zu Propanon statt. Es handelt ich hierbei um Redoxreaktionen.
Aufgabe 5
Aufgabe 6
Oxidationszahlen siehe Lösung zu Aufgabe 5.
Aufgabe 7
Die Moleküle beider Verbindungen besitzen unpolare Methyl- bzw. Ethylgruppen und eine polare Carbonylgruppe. Zwischen den Molekülen, die etwa gleich groß sind, herrschen somit London-Kräfte und Dipol-Dipol-Kräfte von nahezu gleicher Stärke.
Propanon hat eine höhere Siedetemperatur als Propanal. Propanon und Propanal sind beides polare Moleküle ohne Möglichkeit, zueinander Wasserstoffbrücken zu bilden. Daher ist die Stärke der intermolekularen Wechselwirkung vom Dipolmoment dominiert.
Das Propanon-Molekül ist relativ starr und flach, nur die Mehtylgruppen sind um die Bindungsachsen verdrehbar. Dies führt zu einem geringeren Raumanspruch und deshalb zu einer besseren Wechselwirkung der Propanonmoleküle untereinander. Bei Propanal kann sich die Ethylgruppe mehr raumbeanspruchend drehen. Dies hat schlechtere Dipolwechselwirkungen und deshalb einen niedrigeren Siedepunkt.
Die Carbonylgruppen können über die freien Elektronenpaare des Sauerstoffatoms Wasserstoffbrücken zu den Wasserstoff- Atomen im Wasser-Molekül ausbilden, wodurch die gute Wasserlöslichkeit erklärt wird.
Propanon hat die bessere Wasserlöslichkeit gegenüber Propanal. Das größere Dipolmoment von Propanon liegt darin begründet, dass das Gesamtmolekül am Carbonyl-Sauerstoff eine negative Partialladung und an den Methylgruppen eine positive Partialladung aufweist. Das Carbonyl-C-Atom befindet sich mitten im Molekül und ist für den Gesamtdipol nicht weiter von Bedeutung. Im Vergleich zum Propanon hat das Propanal einen längeren unpolaren Teil, der insgesamt weniger von der polaren Carbonylbindung beeinflusst wird. Somit löst sich Propanon besser in Wasser als Propanal.
Aufgabe 8
In dem Schritt der Abbildung 3 wird das Watesmo-Papier nicht nur in die Lösungen der Produkte, sondern auch in die Lösungen der jeweiligen Alkanole als Edukte getaucht. Somit wird überprüft, ob die Edukte wasserfrei sind. Dies ist notwendig, um die Eindeutigkeit der Ergebnisse zu belegen.
Bei dieser negativen Blindprobe werden nur die Produkte bzw. Edukte der Nachweisprozedur unterworfen, ohne die zu untersuchende Substanz hinzuzufügen. In diesem Fall muss die Reaktion bei den Edukten negativ sein, das heißt, die typische Reaktion darf nicht stattfinden, da ja die entsprechende Substanz, in diesem Fall das Wasser, nicht in den beiden Alkanolen enthalten ist. Träte die Reaktion (Blaufärbung des Watesmo-Papiers) doch ein, so sind die Edukte verunreinigt und für diesen Nachweis unbrauchbar. Die negative Blindprobe stellt in diesem Fall sicher, dass die Substanz, das Wasser, in den Edukten, den beiden Alkanolen, nicht gefunden wird, wenn sie nicht vorhanden ist.
______________________________________________
Seite 105
Isobuten – ein bedeutender Grundstoff in der Industrie
Aufgabe 1
a 2-Methylprop-1-en oder 2-Methylpropen
b
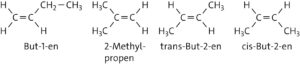
(Im Materialteil der Aufgabe wurde Isobuten [2-Methylpropen] vorgegeben.)
Aufgabe 2
a Zur Gewinnung von Isobuten wird ausgehend von Erdöl ein Gemisch der vier verschiedenen Isomeren des Butens hergestellt. Da deren Siedetemperaturen sehr dicht beieinanderliegen, erfolgt die Abtrennung durch Reaktion mit Wasser. Schwefelsäure dient dabei als Katalysator. Isobuten reagiert etwa 100-mal schneller mit Wasser als die anderen Isomere des Butens. Das Produkt, der Alkohol 2-Methylpropan-2-ol, wird anschließend durch Erhitzen wieder in Isobuten und Wasser gespalten, wobei reines Isobuten entsteht.
b Bei der Reaktion von Isobuten mit Wasser findet eine säurekatalysierte elektrophile Addition statt. Zunächst überträgt ein im Reaktionsgemisch enthaltenes Oxonium-Ion ein Proton auf die Doppelbindung des IsobutenmoleIsobutenmoleküls, sodass ein positiv geladenes Carbenium-Ion entsteht. Nach der Regel von Markownikow wird das elektrophil angreifende Proton selektiv an das Kohlenstoffatom mit der höheren Anzahl von Wasserstoffatomen angelagert, hier an das C-1-Atom.

Im nächsten Schritt reagiert ein Wassermolekül mit dem Carbenium-Ion (C-2-Atom). Nach Abspaltung des Protons entsteht daher nahezu ausschließlich 2-Methylpropan-2-ol.
Aufgabe 3
a
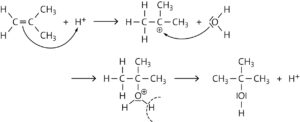
b Reaktionstyp: (säurekatalysierte) elektrophile Addition
c Bei der säurekatalysierten Addition eines Wassermoleküls an das unsymmetrische 2-Methylprop-1-en-Molekül sind prinzipiell zwei Produkte möglich: 2-Methylpropan-1-ol oder 2-Methylpropan-2-ol.
Damit sich das 2-Methylpropan-1-ol bilden könnte, müsste das im ersten Schritt angreifende Proton an das C-2-Atom angelagert werden. Nach der Regel von Markownikow wird jedoch das Proton selektiv an das C-1-Atom mit der höheren Anzahl von Wasserstoffatomen angelagert, weil das Carbenium-Ion durch die +I-Effekte der Methylgruppen am tertiären Kohlenstoffatom stabilisiert wird (links). Die rechte Struktur wird dagegen weniger gut durch +I-Effekte stabilisiert als die linke. Das Wassermolekül greift daher im zweiten Schritt fast aus schließlich an das C-2-Atom des Carbenium-Ions an.
Aufgabe 4
a
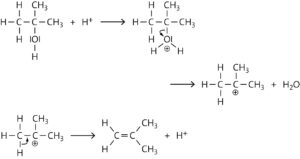
Unter der katalytischen Wirkung einer Säure können Alkoholmoleküle Wassermoleküle abspalten. Dabei entstehen Alkenmoleküle. Der Mechanismus ist eine säurekatalysierte Dehydratisierung von Alkoholen. Die Reaktion startet durch Übertragung eines Protons vom Säuremolekül auf die Hydroxygruppe des Alkoholmoleküls. Das so entstandene Alkyloxonium-Ion spaltet ein Wassermolekül ab (Dehydratisierung). Durch Deprotonierung wird das Proton zurückgewonnen.
b Reaktionstyp: Eliminierung
Die Eliminierung führt durch Abspaltung eines Wassermoleküls zur Ausbildung einer Mehrfachbindung. So wird aus einem gesättigten Molekül ein ungesättigtes gebildet. Die Eliminierung ist die Umkehrreaktion der Addition.
Aufgabe 5
Gemeinsamkeiten: In beiden Fällen wird konzentrierte Schwefelsäure als Katalysator eingesetzt. In beiden Fällen wird das Gemisch erhitzt, damit es zur Reaktion kommt. Als Produkt entstehen im technischen Verfahren wie im Schülerversuch Isobuten. Dabei wird pro Molekül Isobuten ein Proton und ein Wassermolekül abgespalten.
Unterschiede: Im technischen Verfahren werden als Edukte die vier Isomere des Butens verwendet. Dabei reagiert nur Isobuten zu 2-Methylpropan-2-ol. Die übrigen drei Isomere werden abgeführt. Erst danach findet die Eliminierung von Wasser statt. Grundsätzlich findet der technische Prozess in industriellen Anlagen statt, während im Schülerversuch Laborgeräte verwendet werden.
Aufgabe 6
– Hypothese zu Versuch B: Das entstehende Gas ist brennbar.
Begründung: Es entsteht Isobuten, ein ungesättigter Kohlenwasserstoff (Alken). Mit dem Sauerstoff der Luft kann Isobuten in einer vollständigen Verbrennung zu Wasser und Kohlenstoffdioxid reagieren.
– Hypothese zu Versuch C: Das Bromwasser entfärbt sich.
Begründung: Es entsteht Isobuten, ein ungesättigter Kohlenwasserstoff (Alken). Mit dem im Bromwasser gelösten Brom reagiert Isobuten in einer elektrophilen Addition. Die Entfärbung von Bromwasser ist ein Nachweis für Mehrfachbindungen.
______________________________________________
Seite 106
Aromatische Kohlenwasserstoffe
Aufgabe 1
Benzen, der systematische Name nach IUPAC-Nomenklatur, weist auf die im Molekül enthaltenen Doppelbindungen hin. Die Endung -ol des Namens Benzol bezeichnet im Allgemeinen Moleküle, die mindestens eine Hydroxygruppe (OH-Gruppe) besitzen.
Der Name Benzol ist deshalb verwirrend, jedoch aus historischen Gründen im Deutschen weiterhin gebräuchlich.
Aufgabe 2
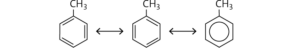
Das Toluolmolekül (Methylbenzolmolekül) besitzt die gleiche Grundstruktur wie das Benzolmolekül: Es weist drei delokalisierte Doppelbindungen und sechs sp2-hybridisierte Kohlenstoffatome im Ring auf, die den aromatischen Charakter bestimmen.
Aufgabe 3
Elektrophile Substitution (SE):
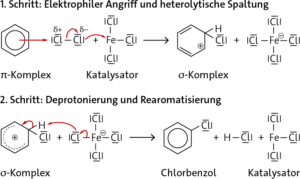
Aufgabe 4
| Elektrophile Substitution der Aromaten | Elektrophile Addition der Alkene | |||
| Edukte |
|
|
|
|
| Produkte | Brombenzol Bromwasserstoff HBr | 1,2-Dibromethan | ||
| Reaktionsbedingungen | Katalysator erforderlich, z. B. Eisenbromid FeBr3 | Keine besonderen Bedingungen | ||
| Art des angreifenden Teilchens | Kation | Polarisiertes Brommolekül | ||
Aufgabe 5
Aufgrund des + M-Effekts der OH-Gruppe ist die Elektronendichte im Ring des Phenolmoleküls erhöht. Die Bildung des π-Komplexes wird daher erleichtert (elektrophiler Angriff). Zudem tritt eine stabilisierende Wirkung auf den σ-Komplex ein, sodass die ortho- und die para-Stellung bevorzugt gebildet werden.
Aufgabe 6
Der + M-Effekt der NH2-Gruppe im Anilinmolekül hat eine stabilisierende Wirkung auf den σ-Komplex, daher werden die ortho- und die para-Stellung bevorzugt gebildet. Daraus folgt, dass elektrophile Substitutionen an Position 2 und 4 des Benzolrings bevorzugt erfolgen (Position 6 entspricht Position 2).
Aufgabe 7
a Mesomeriestabilisierung: Ursache für die saure Reaktion des Phenolmoleküls ist die Wechselwirkung der Hydroxygruppe mit dem π-Elektronensystem des aromatischen Rings. Dadurch wird die Bindung in der Hydroxygruppe stärker polarisiert und das Proton kann leichter abgegeben werden.
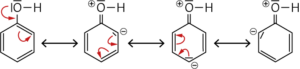
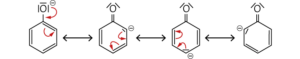
Eine weitere Ursache für die saure Reaktion liegt in der Stabilität des Phenolat-Ions, denn die negative Ladung ist nicht ausschließlich am Sauerstoffatom lokalisiert, sondern über den gesamten aromatischen Ring verteilt.
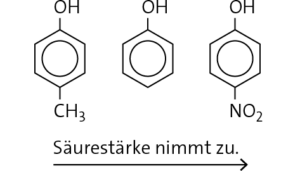
b 4-Nitrophenol ist acider als Phenol, weil die NO2-Gruppe einen elektronenziehenden − M-Effekt besitzt. 4-Methylphenol ist weniger acide als Phenol, da die CH3-Gruppe dagegen einen elektronenschiebenden + I-Effekt aufweist.
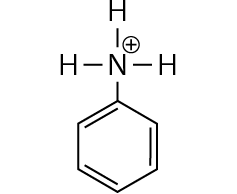
Aufgabe 8
In Gegenwart von Säuren wird die Aminogruppe (NH2-Gruppe) protoniert. Es entsteht C6H5–NH3+. Diesem Molekül-Ion fehlt an der Aminogruppe ein freies Elektronenpaar, das zur Mesomerie stabilisierung miteinbezogen werden könnte. Daher reagiert
Anilin in saurer Lösung nur schlecht.
Aufgabe 9
a Reaktionsprodukte werden entsprechend den Reaktionsbedingungen gebildet:
Entsprechend der KKK-Regel (Katalysator, niedrige Temperaturen, am „Kern“) entstehen ortho- und para-Bromtoluol sowie Bromwasserstoff.
Entsprechend der SSS-Regel (hohe Temperatur, Einfluss von Licht, an der Seitenkette) werden Benzylbromid sowie Bromwasserstoff gebildet.
b
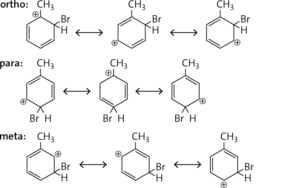
c Die CH3-Gruppe ist ein aktivierender Substituent mit + I-Effekt und dirigiert den Zweitsubstituenten in ortho- und para-Stellung. Bei einer Substitution in meta-Stellung gibt es keine Grenzstruktur, an der die positive Ladung am C-Atom mit der Methylgruppe auftritt. Der σ-Komplex ist daher weniger stabil.
Aufgabe 10
a 1,2-Dihydroxybenzol (bzw. 1,2-Dihydroxybenzen)
1,3-Dihydroxybenzol (bzw. 1,3-Dihydroxybenzen)
1,4-Dihydroxybenzol (bzw. 1,4-Dihydroxybenzen)
b
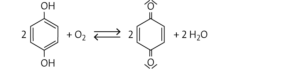
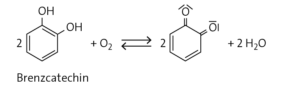
Merkmale der Chinone: Oxidationsprodukte von verschiedenen Phenolen; Derivate des Benzols, bei denen unter Aufhebung der Aromatizität des Rings an zwei Kohlenstoffatomen die Wasserstoffatome durch Sauerstoffatome ersetzt wurden; Oxidationsmittel
c Im Resorcinmolekül sind die OH-Gruppen in meta-Stellung gebunden. Bei einer Oxidation lassen sich die verbleibenden Doppelbindungen nicht mehr im Ring verteilen, ohne die sp2-Hybridisierung der Kohlenstoffatome aufzuheben.
______________________________________________
Seite 107
Salicylsäure und Co.
Aufgabe 1
Das Salicylsäuremolekül enthält eine Carboxygruppe -COOH und eine Hydroxygruppe -OH; Salicylsäure ist daher eine Hydroxycarbonsäure.
Aufgabe 2
a
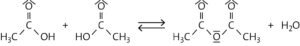
b Es handelt sich um eine Kondensation. Der Namensbestandteil „-anhydrid“ („wasserfrei“) deutet auf die Bildungsreaktion hin: Anhydride entstehen formal durch Abspaltung von Wasser (Dehydratisierung) aus einer Säure.
c Essigsäureanhydrid könnte man formal betrachtet auch als Ester auffassen, da die Hydroxygruppe des einen Essigsäuremoleküls mit der Carboxygruppe des anderen reagiert. Die Esterbildung ist jedoch definiert als eine Kondensation zwischen der Hydroxygruppe eines Alkoholmoleküls (Abspaltung des Protons) mit der Carboxygruppe eines Carbonsäuremoleküls (Abspaltung der OH-Gruppe). Daher handelt es sich tatsächlich nicht um einen Ester.
Aufgabe 3
a
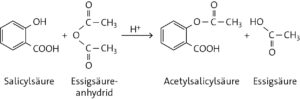
Reaktionsprodukte: Acetylsalicylsäure und Essigsäure
b Schwefelsäure hat bei dieser Veresterung die Funktion eines Katalysators (säurekatalysierte Veresterung). Die Reaktionsgeschwindigkeit wäre ohne Katalysator zu gering.
Hinweis: Die Schülerinnen und Schüler müssen erkennen, dass es sich um eine Veresterung handelt, die säurekatalysiert verläuft. Die Schwierigkeit besteht darin, dass sie auf das Zwischenprodukt Essigsäure kommen müssen, die ein zweites Mal nucleophil angreift: Durch die Protonierung des als Zwischenprodukt gebildeten Essigsäuremoleküls entsteht am C-Atom der Carboxygruppe eine positive Ladung, die den nucleophilen Angriff des Sauerstoffatoms der Hydroxygruppe erleichtert.
c Es muss wasserfrei gearbeitet werden, da ansonsten das Anhydrid mit Wasser wieder zu Essigsäure zurückreagieren würde (vgl. Lösung zu Aufgabe 2a).
Aufgabe 4
a
Synthese von Wintergrünöl:
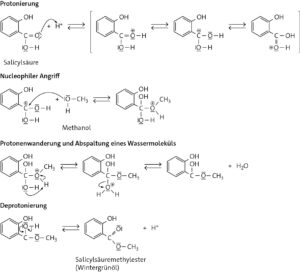
b Salicylsäuremethylester (auch: Methylsalicylat)
Aufgabe 5
Im warmen Wasser des Bades kommt es zu Rückreaktion (Hydrolyse) und es bilden sich Salicylsäure und Methanol:
Salicylsäuremethylester + Wasser → Salicylsäure + Methanol
Ähnlich wie Aspirin hemmt Salicylsäure Entzündungen und lindert Schmerzen.
© Cornelsen Verlag GmbH