Lösungen zu Check-up
Kapitel 4 Redoxchemie und Elektrochemie
________________________________________________________
Seite 82
Aufgabe 1
a
2 Mg + CO2 → 2 MgO + C
Red 2 + Ox 1 → Ox 2 + Red 1
Oxidation; Reduktion
b
II -II IV -II II IV -II
MgO + CO2 ⟶ Mg C O3
Keine Redoxreaktion, da sich die Oxidationszahlen nicht ändern.
Aufgabe 2
a
I -I 0 0
2 NaN3 ⟶ 2 Na + 3 N2 ⇒ Redoxreaktion
0 V I 0
10 Na + 2 KNO3 ⟶ K2O + 5 Na2O + N2 ⇒ Redoxreaktion
I -II I -II IV -II I IV -II I IV -II
K2O + Na2O + 2 SiO2 ⟶ K2SiO3 + Na2SiO3 ⇒ keine Redoxreaktion
b 3 CH4N4O2 + 2 KClO3 ⟶ 6 N2 + 6 H2O + 3 CO2 + 2 KCl
c Für Natriumazid:
V1(N2) = \( \rm { \frac {3\ ·\ 24,5\ l\ ·\ mol^{-1}} {2\ ·\ 65\ g\ ·\ mol^{-1}} } \) · 10 g = 5,65 l
m(Na) = \( \rm { \frac {2\ ·\ 23\ g\ ·\ mol^{-1}} {2\ ·\ 65\ g\ ·\ mol^{-1}} } \) · 10 g = 3,54 g
V2(N2) = \( \rm { \frac {1\ ·\ 24,5\ l\ ·\ mol^{-1}} {10\ ·\ 23\ g\ ·\ mol^{-1}} } \) · 3,54 g = 0,38 l
V(N2) = 5,65 l + 0,38 l = 6,03 l
Für Nitroguanidin:
V(Gas) = \( \rm { \frac {15\ ·\ 24,5\ l\ ·\ mol^{-1}} {3\ ·\ 104\ g\ ·\ mol^{-1}} } \) · 10 g = 11,78 l
Aus Nitroguanidin wird mehr als doppelt so viel Gas freigesetzt.
Aufgabe 3
a Nur beteiligte Ionen berücksichtigt:
5 Fe2+ + MnO4− + 8 H+ ⟶ 5 Fe3+ + Mn2+ + 4 H2O
b c(FeSO4) = \( \frac {5\ ·\ c\rm {(KMnO_4)}\ ·\ V\rm {(KMnO_4-Lsg.)}} {V\rm {(FeSO_4-Lsg.)}} \)
c(FeSO4) = \( \rm { \frac {5\ ·\ 0,01\ mol\ ·\ l^{−1}\ ·\ 8\ ml} {50 ml} } \) = 0,008 mol · l−1
Aufgabe 4
a 2 NH4NO3 ⟶ 2 N2 + 4 H2O + O2
b Benzin reagiert in einer exothermen Reaktion mit dem gebildeten Sauerstoff.
2 C8H18 + 25 O2 ⟶ 16 CO2 + 18 H2O
Aufgabe 5
a Eisen ist unedel. Gold ist sehr edel.
b Eisenoxid (Fe2O3), Eisensulfid (FeS)
Sulfide rösten: 2 FeS + 3 O2 ⟶ 2 FeO + 2 SO2 Oxide mit Kohlenstoff umsetzen:
2 FeO + C ⟶ 2 Fe + CO2
2 Fe2O3 + 3 C ⟶ 4 Fe + 3 CO2
Aufgabe 6
a
0 I II 0
Zn + 2 H3O+ ⟶ Zn2+ + 2 H2O + H2
0 I II 0
Fe + 2 H3O+ ⟶ Fe2+ + 2 H2O + H2
Redoxreaktionen, da sich die Oxidationszahlen verändern.
b Oxonium-Ionen können gegenüber Atomen von unedlen Metallen wie Zink und Eisen als Oxidationsmittel wirken. Gegenüber edlen Metallen wie Kupfer allerdings nicht.
Aufgabe 7
a Abgemessenes Volumen Probelösung vorlegen.
Bürette mit Kaliumpermanganatlösung (Maßlösung) auffüllen und ablesen.
Titrieren, bis keine Entfärbung mehr eintritt. Endstand ablesen und Verbrauch ermitteln.
b
Reduktion: MnO4− + 8 H+ + 5 e− ⟶ Mn2+ + 4 H2O | · 2
Oxidation: H2O2 ⟶ 2 H+ + O2 + 2 e− | · 5
Redoxreaktion: 2 MnO4− + 5 H2O + 6 H+ ⟶ 2 Mn2+ + 8 H2O + 5 O2
c
n(H2O2) = \( \frac {5}{2} \) · c(KMnO4) · V(KMnO4)
= \( \frac {5}{2} \) · 0,1 mol · l−1 · 37,5 ml = 9,375 mmol
m(H2O2) = 9,375 mmol · 34 g · mol−1 = 318,75 mg
β(H2O2) = \( \rm { \frac {318,75\ mg}{200\ ml} } \) = = 1,59 g · l−1
Aufgabe 8
a
I III -II IV -II
Na2S2O4 SO2
Die Oxidationszahl der Schwefelatome wird größer, sodass Natriumdithionit oxidiert wird. Es ist ein Reduktionsmittel.
b Als Reduktionsmittel sollte es z. B. mithilfe der Manganometrie quantitativ bestimmbar sein, da bei dieser Titration Permanganat-Ionen zu Mangan(II)-Ionen reduziert werden.
________________________________________________________
Seite 83
Aufgabe 9
a In beiden Halbzellen bildet sich jeweils ein elektrochemisches Gleichgewicht aus, das von der Art der Elektroden abhängt.
Cu \( \rightleftharpoons \) Cu2+ + 2 e−
Ag \( \rightleftharpoons \) Ag+ + e−
Da Cu2+-Ionen ein größeres Bestreben haben, in Lösung zu gehen, als Ag+-Ionen, ist das Kupferblech im Vergleich zum Silberblech stärker negativ aufgeladen. Die beiden Halbzellen weisen verschiedene Potenziale auf. Der Unterschied führt zu einer messbaren Spannung von 0,4 V.
b
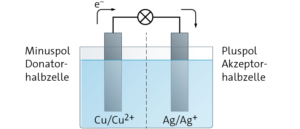
c Minuspol: Cu(s) ⟶ Cu2+(aq) + 2 e−
Pluspol: 2 Ag+(aq) + 2 e− ⟶ 2 Ag(s)
Aufgabe 10
a Reduktionswirkung: Al > Fe > Cu > Au
Auf dem Al-Stab scheiden sich alle drei anderen Metalle ab. Es hat daher die größte Reduktionswirkung. Auf dem Fe-Stab scheiden sich nur Kupfer und Gold ab. Auf dem Cu-Stab scheidet sich nur Gold ab und auf dem Au-Stab scheidet sich kein anderes Metall ab. Es hat die geringste Reduktionswirkung.
b
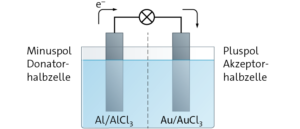
c U = E(Reduktion) − E(Oxidation)
= E0(Au/ Au3+) − E0(Al/ Al3+) = 1,50 V − (− 1,66 V) = 3,16 V
Aufgabe 11
a Teilweise offene Aufgabenstellung:
U(Zn/ Zn2+ // Ag+/ Ag) = 1,56 V
U(Zn/ Zn2+ // Pt2+/ Pt) = 1,96 V
U(Zn/ Zn2+ // Au3+/ Au) = 2,26 V
U(Li/ Li+ // Ag+/ Ag) = 3,84 V
b Eine Batterie ist eine galvanische Zelle, die zur mobilen Stromerzeugung genutzt werden kann. Die beiden Halbzellen werden in einem Baukörper verbaut (oft Zylinder), der außen geschlossen ist, damit die Batterie in einem Verbraucher genutzt werden kann. Häufig werden nichtflüssige Elektrolyte verwendet. Bei Anschluss eines Verbrauchers laufen die freiwilligen galvanischen Reaktionen ab. Elektronen fließen von der Donator- zur Akzeptorhalbzelle. Chemische Energie wird in elektrische Energie umgewandelt. Beispiele: Zink-Kohle-Batterie; Alkali-Mangan-Batterie.
Aufgabe 12
a Die Coincell ist eine galvanische Zelle aus einer Lithiumhalbzelle und einer MnO2/ Mn3+Halbzelle.
Anode (Elektronendonator):
0 I
Li ⟶ Li+ + e–
Kathode (Elektronenakzeptor):
IV I I III
MnO2 + Li+ + e– ⟶ LiMnO2
Zellreaktion: Li + MnO2 ⟶ LiMnO2
b hohes Redoxpotenzial von Lithium, geringe Masse (hohe Energiedichte)
c Wasserfreier, trotzdem leitfähiger Elektrolyt, sehr dichte Bau form, da es sonst zur Reaktion von Lithium mit Wasser unter Wasserstoffentwicklung kommt.
Aufgabe 13
a Bildung eines Lokalelements aus dem unedleren Aluminium und dem Eisen in der Stahlpfanne. Lasagne enthält durch die Tomatensauce H+-Ionen.
Al ⟶ Al3+ + 3 e− (Oxidation)
2 H+ + 2 e− ⟶ H2 (Reduktion)
2 Al + 6 H+ ⟶ 2 Al3+ + 3 H2 (Redoxreaktion)
b Nein, da dann kein Lokalelement aus zwei Metallen entstehen kann.
c Aluminium als Verpackungsmaterial sollte unbedenklich sein, Al3+Ionen können z. B. durch Erhitzen nicht entfernt werden; saure Lebensmittel sollten nicht in Aluminium verpackt werden.
Aufgabe 14
Synonyme untereinander sind:
| Halbzelle | Anode (Ort der Oxidation) | Kathode (Ort der Reduktion) | Redoxpotenzial |
| Elektrode | Elektronendonator | Elektronenakzeptor | Elektrodenpotenzial |
| Elektrochemische Zelle | Minuspol | Pluspol |
Die Begriffe Halbzelle und Elektrode bezeichnen die Kombination aus Metall und Elektrolytlösung. Elektrode wird häufig auch nur für das Metall verwendet. Der Begriff Halbzelle weist darauf hin, dass eine zweite Halbzelle erforderlich ist, um eine galvanische Zelle zu erhalten, das leistet der Begriff elektrochemische Zelle nicht. Die Begriffe Anode / Kathode für die Vorgänge der Oxidation / Reduktion sind ebenso eindeutig wie Elektronendonator / -akzeptor. Die Begriffe Minuspol / Pluspol sind problematisch, da die Ladung selbst nichts über die Art der Reaktion aussagt. Bei galvanischen Zellen erfolgt am Minuspol die Oxidation, bei Elektrolysen die Reduktion. Redoxpotenzial zielt auf das Verhalten des Systems in einer Redoxreaktion ab, also auf die Fähigkeit, einen Partner zu oxidieren bzw. zu reduzieren. Das Elektrodenpotenzial ist physikalisch als elektrisches Potenzial zu verstehen.
Aufgabe 15
a

Anode (Minuspol): Zn ⟶ Zn2+ + 2 e−
Kathode (Pluspol): MnO2 + 2 H2O + 2 e− ⟶ 2 MnOOH + 2 OH−
b Nach Nernst sinkt mit steigender Konzentration der Zn2+-Ionen das Potenzial der Halbzelle Zn/Zn2+.
c Die Anode ist der Zinkbecher, der sich während der Benutzung der Batterie auflöst.
d Beide Batterien enthalten Zink und Mangandioxid, dürfen nicht im Hausmüll entsorgt werden. Alkaline halten doppelt so lange, sind auslaufsicher und ihre Spannung bleibt länger konstant.
____________________________________________________________________
Seite 84
Aufgabe 16
a U(Zn/ Zn2+ // Ni2+/ Ni) = − 0,23 V − (− 0,76 V) = 0,53 V
b U(Cu/ Cu2+ // Ag+/ Ag) = 0,8 V − 0,35 V = 0,45 V
c Bei der geringeren Elektrolytkonzentration verlagert sich das elektrochemische Gleichgewicht an den Elektroden auf die Seite der Ionenbildung, das Potenzial wird also negativer.
Nach Nernst gilt im ersten Fall für beide Halbzellen:
E = E0(Me/ Me2+) + \( \frac {{\rm 0,059\ V}} {2} \) · lg 0,1
Im Ergebnis ändert sich die Zellspannung der galvanischen Zelle nicht, da sich der Effekt gegenseitig aufhebt:
U = E0(Ni/ Ni2+) + \( \frac {{\rm 0,059\ V}} {2} \) · lg 0,1 −(E0(Zn/ Zn2+) + \( \frac {{\rm 0,059\ V}} {2} \) · lg 0,1)
= E0(Ni/ Ni2+) − E0(Zn/ Zn2+) = 0,53 V
Im Fall b unterscheiden sich die beiden Halbzellen durch die Anzahl z der ausgetauschten Elektronen. Das Redoxpotenzial der Silberhalbzelle ändert sich um 0,059 V · lg 0,1 = − 0,059 V. Das Redoxpotenzial der Kupferhalbzelle um \( \frac {1}{2} \) · 0,059 V · lg 0,1 = − 0,0295 V. Daher sinkt die Zellspannung um 0,0295 V auf 0,4205 V.
Aufgabe 17
a 2 H2O(l) O2(g) + 4 H+ + 4 e−
Nernst-Gleichung:
E(Red/ Ox) = E0(Red/ Ox) + \( \frac {{\rm 0,059\ V}} {{\rm z}} · lg \frac {c{\rm (Ox)}}{c{\rm (Red)}} \)
E(H2O/ H+) = E0(H2O/ H+) + \( \frac {{\rm 0,059\ V}} {4} · lg \frac {c^4{\rm (H^+)}\ ·\ c{\rm (O_2)}}{c^2{\rm (H_2O)}} \)
Es gilt: c(O2) = 1 mol · l−1, c(H2O) = 1 mol · l−1
E(H2O/ H+) = E0(H2O/ H+) + \( \frac {{\rm 0,059\ V}} {4} \) · lg c4 (H+)
E(H2O/ H+) = E0(H2O/ H+) − 0,059 V · pH
b
| pH Wert | Halbzellenreaktion | Stoffmengenkonzentration c(H+) in mol · l− | Redoxpotenzial in V |
| 0 | 2 H2O \( \rightleftharpoons\) O2 + 4 H+ + 4 e− |
1 | 1,23 |
| 7 | 4 OH− \( \rightleftharpoons\) O2 + 2 H2O + 4 e− |
10−7 | 0,82 |
| 14 | 4 OH− \( \rightleftharpoons\) O2 + 2 H2O + 4 e− |
10−14 | 0,41 |
In Abhängigkeit vom pH-Wert ist das Redoxpotenzial nach der Nernst-Gleichung für die Oxidationswirkung von Sauerstoffmolekülen in Lösung unterschiedlich.
Aufgabe 18
a Chlor, Wasserstoff, Kalilauge (Kaliumhydroxidlösung)
b Pluspol (Anode):
2 Cl− ⟶ Cl2 + 2 e−
Minuspol (Kathode):
2 H2O + 2 e− ⟶ 2 OH− + H2
________________________________
2 Cl− + 2 H2O ⟶ Cl2 + H2 + 2 OH−
Beim Membranverfahren sind die beiden Halbzellen durch eine spezielle Membran getrennt, die nur für die Kalium-Ionen durchlässig ist. An der Anode entstehen aus den Chlorid-Ionen einer Kaliumchloridlösung Chlor. An der Anode reagieren Wassermoleküle in einer Kalilauge zu Hydroxid-Ionen und Wasserstoffmolekülen. Zum Ladungsausgleich wandern Kalium-Ionen durch die Membran. Dadurch entsteht konzentrierte, hochreine Kalilauge.
c m(KOH) = \( \frac {I\ ·\ t\ ·\ M{\rm (KOH)}} {z\ ·\ F} \)
= \( {\rm \frac {2,5\ ·\ 10^5 A\ ·\ 86 400\ s\ ·\ 56\ g\ ·\ mol^{-1}} {1\ ·\ 96 485\ A\ ·\ s\ ·\ mol^{-1}} } \)
= 1,25 · 107 g = 12,5 t
Aufgabe 19
a
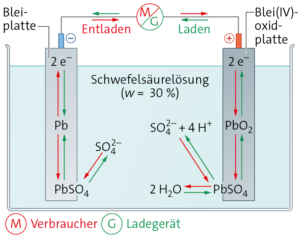
b
Entladen:
Pluspol:
PbO2 + 4 H+ + SO42– + 2 e− ⟶ PbSO4 + 2 H2O
Minuspol:
Pb + SO42– ⟶ PbSO4 + 2 e−
Laden:
Pluspol:
PbSO4 + 2 H2O ⟶ PbO2 + 4 H+ + SO42– + 2 e−
Minuspol:
PbSO4 + 2 e− ⟶ Pb + SO42−
c
m(Pb) = \( \frac {I\ ·\ t\ ·\ M{\rm (Pb)}} {z\ ·\ F} \)
= \( {\rm \frac {52\ ·\ A\ ·\ 3600\ s\ ·\ 207\ g\ ·\ mol^{-1}} {2\ ·\ 96 485\ A\ ·\ s\ ·\ mol^{-1}} } \)
= 200,8 g
Im Bleioxid (PbO2) ist noch mal die gleiche Masse an Blei enthalten, sodass mindestens 401,6 g Blei benötigt werden.
Pb + PbO2 + 2 H2SO4 \( \rightleftharpoons \) 2 PbSO4 + 2 H2O
m(H2SO4) = \( \frac {n {\rm (H_2SO_4)}\ ·\ M{\rm (H_2SO_4)}\ ·\ m{\rm (Pb)}} {n{\rm (Pb)}\ ·\ M{\rm (Pb)}} \)
= \( {\rm \frac {2\ ·\ 98\ g\ ·\ mol^{-1}\ ·\ 200,8\ g} {1\ ·\ 207\ g\ ·\ mol^{-1}} } \)
= 190,1 g
Aufgabe 20
a UZ = E0(2 Br−/ Br2) − E0(Li/ Li+)
= 1,07 V − (− 3,04 V) = 4,11 V
b Aufgrund des hohen negativen Redoxpotenzials von Li / Li+ reagieren am Pluspol Wassermoleküle zu Hydroxid-Ionen und Wasserstoffmolekülen. Das Redoxpotenzial von OH– / H2O ist größer (weniger negativ), sodass eine geringere Zersetzungsspannung resultiert.
Aufgabe 21
a
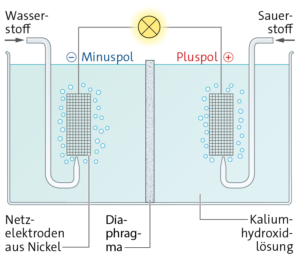
Pluspol (Anode):
2 H2 + 4 OH− ⟶ 4 H2O + 4 e−
(2 H2 ⟶ 4 H+ + 4 e−)
Minuspol (Kathode):
O2 + 2 H2O + 4 e− ⟶ 4 OH−
(O2 + 4 H+ + 4 e− ⟶ 2 H2O)
b
| Brennstoffzelle | Alkaline | |
| Pluspol | Platinelektrode von Wasserstoff umspült | Mangandioxidpaste |
| Minuspol | Platinelektrode von Sauerstoff umspült | Zinkgel |
| Elektrolyt | KOH-Lösung/ PEM | KOH-Lösung |
| Zellspannung | 1,23 V | 1,5 V |
| Eigenschaften | kontinuierlicher Betrieb, Ausgangsstoffe müssen von außen zugeführt werden | nicht wieder aufladbar |
c Die Brennstoffzellentechnologie ermöglicht die Speicherung überschüssiger regenerativer Energie, indem diese zur Elektrolyse von Wasser verwendet wird. Die dabei gebildeten Reaktionsprodukte Wasserstoff und Sauerstoff können zur Energiegewinnung in der Brennstoffzelle eingesetzt werden.
Aufgabe 22
a Magnesium ist ein unedleres Metall als das Eisen in der Stahlklinge. Es dient als Opferanode für die Stahlklinge.
b
Elektronenabgabe / Oxidation:
2 Mg ⟶ 2 Mg2+ + 4 e−
Elektronenaufnahme / Reduktion:
2 H2O + O2 + 4 e− ⟶ 4 OH−
_____________________________________
Elektronenübergang/ Redoxreaktion:
2 Mg + 2 H2O + O2 ⟶ 2 Mg(OH)2
Aufgabe 23
a Kupfer ist durch Passivierung vor Korrosion geschützt.
b Es bildet sich ein Lokalelement, bei dem die verzinkte Regen rinne die Anode bildet, die sich langsam auflöst. Es reicht aus, wenn die Zinkschicht an einer Stelle beschädigt wurde, z. B. beim Festziehen der Kupferschraube.
Anode: Fe ⟶ Fe2+ + 2 e−
Kathode: 2 H2O + O2 + 2 e− ⟶ 4 OH−
________________________________________________________
Seite 85
linke Spalte – Analoge Fotografie
Aufgabe 1
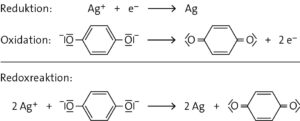
a Beim Belichten des Films bilden sich in den Silberbromid-Kristallen submikroskopische Silberkeime. Das Abbild ist noch nicht sichtbar. Erst durch das Entwickeln wird der Silberkeim vollständig zu Silber umgewandelt. Das Bild wird so (als Negativ) sichtbar.
b
Aufgabe 2
Die in der Silbernitratlösung enthaltenen Silber-Ionen sind empfindlich gegenüber Licht. Sie werden zu elementarem Silber reduziert. Braune Chemikalienflaschen filtern den Großteil des (energiereichen) Lichts heraus und verlängern so die Haltbarkeit der Silbernitratlösung.
Aufgabe 3
In den Fotos befinden sich noch Rückstände von Silberbromid-Kristallen, die mit der Zeit durch das Licht zu elementarem Silber reduziert werden. Diese lassen das Bild gelblich erscheinen.
rechte Spalte – Nitrate in Lebensmitteln
Aufgabe 1
a
b
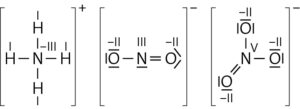
Bildung von Nitrit-Ionen:
Oxidation: NH4+ + 2 H2O → NO2− + 8 H+ + 6 e−
Reduktion: O2 + 4 H+ + 4 e− → 2 H2O
___________________________________________
Redoxreaktion: 2 NH4+ + 3 O2 → 2 NO2− + 4 H+ + 2 H2O
Bildung der Nitrat-Ionen:
Oxidation: NO2− + H2O → NO3− + 2 H+ + 2 e−
Reduktion: O2 + 4 H+ + 4 e− → 2 H2O
___________________________________________
Redoxreaktion: 2 NO2− + O2 → 2 NO3−
Aufgabe 2
a Vorhandene Nitrit-Ionen.
b Enthält die Probe neben Nitrat-Ionen auch Nitrit-Ionen, so wird die zweite Zone (ohne Reduktionsmittel) ebenfalls den Farbstoff bilden. Hier beruht die Reaktion aber auf den schon vorhandenen Nitrit-Ionen, nicht auf den durch Reduktion aus Nitrat-Ionen gebildeten Nitrit-Ionen. Daher ist der Messwert in der reaktiven Zone (mit Reduktionsmittel) größer als allein durch die Nitrat-Ionen verursachte.
________________________________________________________
Seite 86
Knopfzellen für Hörgeräte
Aufgabe 1
a
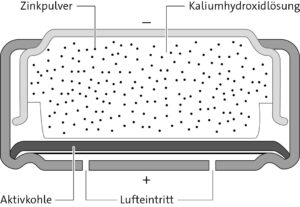
b Minuspol, Anode, Donatorhalbzelle:
Zn + 4 OH− → [Zn(OH)4]2- + 2 e−
Pluspol, Kathode, Akzeptorhalbzelle:
O2 + 2 H2O + 4 e− → OH−
c U = E(Akzeptor) – E(Donator)
= 0,40 V – (−1,23 V) = 1,63 V
d Wie in der Alkaline werden die Hydroxid-Ionen bei der Zink-Luft-Batterie über eine Kaliumhydroxidlösung bereitgestellt.
Gelöstes Kaliumhydroxid reagiert mit Kohlenstoffdioxid zu Kaliumcarbonat. Da der Anteil von Kohlenstoffdioxid in der Luft sehr gering ist, verläuft diese Reaktion nur sehr langsam.
2 KOH(aq) + CO2(g) → K2CO3(s) + H2O(l)
Aufgabe 2
a Li/MnO2 und Zn/O2 weisen die größte Energiedichte auf, mehr als das Doppelte der klassischen Zn/MnO2-Batterie und das Zehnfache der Pb/PbO2-Batterie. Ursache ist das Verhältnis von Masse der eingebrachten Elektrodenmaterialien und die daraus freisetzbare Elektronenanzahl.
In der Zn/O2-Batterie benötigt man nur das Anodenmaterial, Zink und den Elektrolyten, da das Kathodenmaterial Sauerstoff über die Luft in die Zelle gelangt. In der Li/MnO2-Zelle wird das leichte Anodenmaterial Lithium verwendet. Lithium hat eine Atommasse von 6,9 u, Zink ist mit 65,4 u fast 10-mal so schwer. Damit benötigt man nur ein Fünftel der Masse, um theoretisch die gleiche Anzahl an Elektronen bereitzustellen.
b Die Zink-Luft-Batterie hat eine sehr hohe Energiedichte und liefert im Vergleich zu einer Alkali-Mangan-Batterie über einen deutlich längeren Zeitraum eine konstante Spannung. Folglich eignet sie sich gut für kleine Geräte, die einen mäßigen Strombedarf haben, wenn Luft frei zugänglich ist.
c Auch bei Zink-Luft-Batterien fällt Zink als Schwermetall an, aber im Gegensatz zu anderen Batterien wie der Alkaline ist kein zusätzliches Mangandioxid notwendig. Zink-Luft-Batterien haben die Quecksilberoxid-Zink-Batterien ersetzt, die aufgrund der verwendeten Quecksilberverbindungen hoch problematisch waren. Das verwendete Blei im Bleiakku (Pb/PbO2) ist ebenfalls umweltgiftig, sodass bei den zur Verfügung stehenden Batterien die Zink-Luft-Batterie als umweltfreundlich gelten kann.
________________________________________________________
Seite 87
linke Spalte – Entfernung von Iodflecken
Aufgabe 1
-I 0 I 0 -I I
2 I− + Cl2 + 2 Na+ → I2 + 2 Cl− + 2 Na+
Aufgabe 2
a Iod-Moleküle weisen aufgrund der gleichen Elektronegativität zwischen beiden Iod-Atomen lediglich einen temporären Dipol auf. Zwischen ihnen wirken Van-der-Waals-Kräfte (London-Wechselwirkungen). Daher ist die für die Löslichkeit notwendige Ausbildung von Wasserstoffbrücken zu Wasser-Molekülen nur in sehr geringem Maße möglich.
b
Oxidation: 2 H2Asc → Ascox + 2 e− + 2 H+
Reduktion: I2 + 2 e− → 2 I−
____________________________________________________
Zellreaktion: 2 H2Asc + I2 → Ascox + 2 I− + 2 H+
Ascorbinsäure-Moleküle können mit den Iod-Molekülen eine Redoxreaktion eingehen. Dabei gibt das Ascorbinsäure-Molekül zwei Elektronen ab und wird oxidiert, das Iod-Molekül nimmt die zwei Elektronen auf und wird zu Iodid-Ionen reduziert. Iodid-Ionen sind gut Wasser löslich und können so aus dem Kleidungsstück herausgewaschen werden.
c
0 -III -I I -II -II
I2 + 2 OH− → I− + IO− + H2O
Bei dieser Reaktion handelt es sich um eine Disproportionierung, bei der aus einem Iod-Molekül mit zwei Iod-Atomen gleicher Oxidationsstufe zwei verschiedene Teilchen mit Iod-Atomen in unterschiedlichen Oxidationsstufen entstehen.
d Das Standardpotenzial E0 (I2/IO−) ist stark vom pH-Wert abhängig. Es beträgt 1,44 V bei pH = 0 und 0,42 V bei pH = 14. Die resultierende Spannung ist bei hohem pH-Wert, z. B. bei pH = 14, positiv, sodass die Reaktion nur in alkalischer Lösung freiwillig abläuft:
ΔE = E(Reduktion) – E(Oxidation) = 0,54 V – 1,44 V = –0,9 V (bei pH = 0)
ΔE = E(Reduktion) – E(Oxidation) = 0,54 V – 0,42 V = 0,12 V (bei pH = 14)
rechte Spalte – Münzmetalle
Aufgabe 1
a
| Metall | Nickel | Cobalt | Kupfer |
| Salzlösung | |||
| Ni2+-Ionen | / | Nickel-Überzug | Keine Reaktion |
| Co2+-Ionen | Keine Reaktion | / | Keine Reaktion |
| Cu2+-Ionen | Kupfer-Überzug | Kupfer-Überzug | / |
b Cobalt ist das unedelste Metall, denn mit E0 = –0,28 V hat es das niedrigste Standardpotenzial von den drei genannten Metallen. Aus Salzlösungen mit Ni2+-Ionen und Cu2+-Ionen vermag es deren Ionen zu reduzieren.
Kupfer ist das edelste Metall, denn es hat mit E0 = 0,34 V das höchste Standardpotenzial. Es kann aus Salzlösungen mit Ni2+-Ionen und Co2+-Ionen deren Ionen nicht reduzieren. Nickel ist mit E0 = –0,24 V edler als Cobalt, aber unedler als Kupfer. Es reduziert Cu2+-Ionen, aber keine Co2+-Ionen.
c
Co(s) + Ni2+(aq) → Co2+(aq) + Ni(s)
Co(s) + Cu2+(aq) → Co2+(aq) + Cu(s)
Ni(s) + Cu2+(aq) → Ni2+(aq) + Cu(s)
Aufgabe 2
a
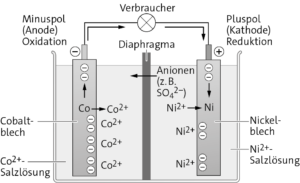
b Am Minuspol (Anode) werden Co-Atome zu Co2+-Ionen oxidiert. Es lösen sich dort Co2+-Ionen aus dem Cobaltblech und wandern in den Elektrolyten (Co2+-Salzlösung), wobei sich die Elektrode negativ auflädt. Am Pluspol (Kathode) lösen sich ebenfalls Ni2+-Ionen aus dem Nickelblech und wandern in die Ni2+-Salzlösung. Weil Nickel edler als Cobalt ist, lösen sich dort jedoch insgesamt weniger Ni2+-Ionen. Entsprechend bleiben an der Nickeloberfläche weniger Elektronen zurück als an der Cobaltoberfläche. Da die beiden Elektroden elektrisch leitend verbunden sind, können die überschüssigen Elektronen vom Minuspol (Cobaltblech) zum Pluspol (Nickelblech) fließen. Am Pluspol treffen Ni2+-Ionen aus der Ni2+-Salzlösung auf die Elektronen in der Elektrode und werden zu Ni-Atomen reduziert. Über das Diaphragma erfolgt der Ladungsausgleich zwischen beiden Halbzellen, indem die Anionen der Ni2+-Salzlösung (z. B. SO42--Anionen einer NiSO4-Salzlösung) in die Cobalthalbzelle wandern.
c
Oxidation: Co(s) → Co2+(aq) + 2 e− (Anode)
Reduktion: Ni2+(aq) + 2 e− → Ni(s) (Kathode)
_________________________________________________
Zellreaktion: Co(s) + Ni2+(aq) → Co2+(aq) + Ni(s)
d U = E (Ni/Ni2+) – E(Co/Co2+) = –0,24 V –(–0,28 V) = 0,04 V
e Die Ni2+-Salzlösung muss verdünnt werden. Dann kommt es zu einer Störung des chemischen Gleichgewichts der Doppelschicht an der Kathode und es gehen mehr Ni2+-Ionen in Lösung. Dadurch lädt sich das Nickelblech stärker negativ auf als das Cobaltblech: Das Nickelblech (Nickel-Halbzelle) wird zum Minuspol (Anode) und das Cobaltblech (Cobalt-Halbzelle) wird zum Pluspol (Kathode), sodass die Polung der Nickel-Cobalt-Zelle umgekehrt wird.
© Cornelsen Verlag GmbH