Lösungen zu Check-up
Kapitel 2 Kinetik und chemisches Gleichgewicht
________________________________________________________
Seite 57
Aufgabe 1
a
\( c {\rm (C_2H_5OH)} = \frac{n {\rm (C_2H_5OH)}}{V {\rm (Blut)}} \)
\( n {\rm (C_2H_5OH)} = \frac {m {\rm (Ethanol)}} {M {\rm (C_2H_5OH)}} \)
\( V {\rm (Blut)} = \frac {m {\rm (Blut)}} {ϱ {\rm (Blut)}} \)
\( c {\rm (C_2H_5OH)} = \frac {m {\rm (Ethanol)}} {m {\rm (Blut)}} · \frac {ϱ {\rm (Blut)}} {M {\rm (C_2H_5OH)}} = \frac {w {\rm (Ethanol)} · ϱ {\rm (Blut)}} {M {\rm (C_2H_5OH)}} \)
\( c {\rm (C_2H_5OH)} = \frac {0,001 · 1060\ {\rm g · l^{-1}}} {46\ {\rm g · mol^{-1}}} = 0,023\ {\rm mol · l^{-1}} \)
b
1 ‰ · h−1 ≙ v = 0,023 mol · l−1 · h−1
0,14 ‰ · h−1 ≙ v ≈ 0,0032 mol · l−1 · h−1
c
Zahl der pro Stunde abgebauten Ethanolmoleküle:
N(C2H5OH) = \( N_A \) · c(C2H5OH) · V(Blut)
= 6 · 1023 mol−1 · 0,0032 mol · l−1 · 5 l
= 9,6 · 1021
N(C2H5OH) = 9,6 · 1021 ≙ t = 1 h
N(C2H5OH) = 7 · 109 ≙ t = x
\( x = \frac {7,3 \ ·\ 10^9\ {\rm h}} {9,6\ ·\ 10^{21}}\)
≈ 7,3 · 10−13 h = 2,6 · 10−9 s
Aufgabe 2
a Durch Erhöhung der Temperatur und durch Verwendung eines Katalysators.
b
\( v = – \frac{1}{2} · \frac {Δc {\rm (H_2O_2)}} {Δt} = – \frac{1}{2} · \frac {(0,01 – 0,1)} {600\ {\rm mol · l^{-1} · s^{-1}} } \)
= 7,5 · 10-5 mol · l−1 · s−1
c
Wenn die Geschwindigkeit v bei ∆T = 10 K verdoppelt wird:
v(+ 30 K) = 23 · v = 8 · v = 6 · 10−4 mol · l−1 · s−1
Wenn die Geschwindigkeit v bei ∆T = 10 K vervierfacht wird:
v(+ 30K) = 43 · v = 64 · v = 4,8 · 10−3 mol · l−1 · s−1
Aufgabe 3
a Chemische Reaktionen in Lösung: Hinreaktion wird langsamer und Rückreaktion schneller, bis beide mit gleicher Geschwindigkeit verlaufen.
Verdunsten von Wasser in einem geschlossenem Gefäß: Wassermoleküle gehen von flüssigem Wasser in Gasphase. Dadurch steigt die Zahl der Wassermoleküle in der Gasphase und auch die Zahl der Übergänge von der Gasphase in die flüssige Phase. Nach einiger Zeit verlaufen beide Vorgänge mit gleicher Geschwindigkeit.
Lösen eines Salzes in Wasser: Aus dem Salzkristall diffundieren Ionen zwischen die Wassermoleküle und es lagern sich Ionen aus der Lösung wieder an den Salzkristall an.
b Gemeinsamkeit: Im Gleichgewicht sind Hin- und Rückprozess gleich schnell.
Unterschied: Chemische Reaktion: Nur eine Phase; Verdunsten und Löslichkeitsgleichgewicht: zwei Phasen.
c Dynamisches Gleichgewicht: Vorgänge, die zum Gleichgewicht geführt haben, verlaufen auch im Gleichgewicht noch. Konzentrationen verändern sich nicht mehr, es finden gleich viele reaktive Stöße für Hin- und Rückprozess statt. Bei Störung eines dynamischen Gleichgewichts reagiert das System so, dass ein neues Gleichgewicht erreicht wird.
Statisches Gleichgewicht: Vorgänge, die zum Gleichgewicht geführt haben, verlaufen nicht mehr. Wenn ein statisches Gleichgewicht (z. B. eine Balkenwaage) gestört wird, erreicht das System keinen neuen Gleichgewichtszustand.
Aufgabe 4
a 2 SO2(g) + O2(g) 2 SO3(g)
\( K_{\rm C} = \frac {c^2 {\rm (SO_3)}}{c^2 {\rm (SO_2)} \ ·\ c {\rm (O_2)}} \)
b
\( K_{\rm C} {\rm (Bildung)} = \frac {(0,9\ {\rm mol · l^{-1}})^2} {(0,1\ {\rm mol · l^{-1}})^2 \ · \ 0,05\ {\rm mol · l^{-1}}} = 1620 \ {\rm l · mol^{-1}} \)
\( K_{\rm C} {\rm (Zersetzung)} = \frac {1} {K_{\rm C} {\rm (Bildung)}} = 6,17 · 10^{-4}\ {\rm mol · l^{-1}} \)
c
Eine Erhöhung von c(O2) beschleunigt die Bildungsreaktion von Schwefeltrioxid. Bis sich das Gleichgewicht wiedereingestellt hat, nimmt daher c(SO2) ab und c(SO3) zu.
\( K_{\rm C} {\rm (Bildung)} = \frac {c^2 {\rm (SO_3)}} {c^2 {\rm (SO_2)}\ ·\ c {\rm (O_2)}} \)
\( \frac {c {\rm (SO_3)}} {c {\rm (SO_2)}} = \sqrt {K_C · c{\rm (O_2)}} = \sqrt {1620\ {\rm l · mol^{-1}} · 0,80 {\rm mol · l^{-1}} } = 36 \)
Aufgabe 5
a Bei Salz I steigt die Löslichkeit mit der Temperatur, d. h., das Gleichgewicht wird dabei auf die Seite des gelösten Salzes verschoben. Nach dem Prinzip von Le Chatelier muss es sich beim Lösevorgang um einen endothermen Vorgang handeln.
Für Salz III folgt mit analoger Argumentation, dass der Lösevorgang exotherm ist. Die Löslichkeit von Salz II hängt nicht von der Temperatur ab, d. h., es löst sich weder exotherm noch endotherm.
b Die Kristallisation ist der Umkehrvorgang zur Lösung mit einer entgegengesetzten Wärmetönung. Da die Kristallisation beim Taschenwärmer exotherm sein muss, eignet sich nur Salz I, das sich endotherm löst.
Aufgabe 6
a N2(g) + O2(g) \( \rightleftharpoons \) 2 NO(g) | ∆H > 0
Reaktion ist endotherm (∆H > 0), d. h., eine Temperaturerhöhung führt zu einer Neueinstellung des Gleichgewichts mit einem höheren Produktanteil. Da sich die Zahl der Teilchen in der Gasphase in der Reaktion nicht verändert, hat der Druck keinen Einfluss auf die Lage des Gleichgewichts.
b N2(g) + 3 H2(g) \( \rightleftharpoons \) 2 NH3(g) | ΔH < 0
Reaktion ist exotherm (∆H < 0), d. h., eine Temperatursenkung führt zu einer Neueinstellung des Gleichgewichts mit einem höheren Produktanteil. Da die Zahl der Teilchen in der Gasphase mit der Hinreaktion abnimmt, wird das Gleichgewicht durch steigenden Druck auf die rechte Seite verschoben.
________________________________________________________
Seite 58
linke Spalte: Zwischenfall im Labor
Aufgabe 1
a
– Durch Rühren oder durch Erhöhung der Konzentration eines Ausgangsstoffs: Die Wahrscheinlichkeit für das Zusammentreffen von Edukt-Teilchen wird erhöht.
– Durch Erhöhung der Temperatur: Die Wahrscheinlichkeit für reaktive Stöße steigt, weil mehr Teilchen ausreichend viel Energie haben, um bei einem Zusammenstoß die Aktivierungsbarriere zu überwinden.
– Durch Verwendung eines Katalysators: Die Wahrscheinlichkeit für reaktive Stöße steigt, weil der Katalysator einen Reaktionspfad mit kleinerer Aktivierungsenergie ermöglicht.
b RGT-Regel: Die Geschwindigkei einer „einfachen“ Reaktion vergrößert sich um den Faktor zwei bis vier, wenn die Temperatur um 10 K erhöht wird. Die Reaktion X + T → A + E ist exotherm und die thermische Energie erhöht die Temperatur der Lösung.
c Um eine Temperaturerhöhung und damit eine Beschleunigung der Reaktion zu vermeiden, muss die thermische Energie aus dem System entfernt werden. Das gelingt durch Kühlung.
Aufgabe 2
a
– Katalysator: Ein Katalysator ermöglicht einen alternativen Reaktionsweg mit verringerter Aktivierungsenergie. Es kommt zu einer Wechselwirkung der Katalysatorteilchen mit den Eduktteilchen. Da die Katalysatorteilchen wieder zurückgebildet werden, tauchen sie in der Reaktionsgleichung nicht auf.
– Autokatalyse: Vorgang, bei dem ein Produkt die Reaktion, in der es entsteht, katalysiert.
b In einer autokatalytischen Reaktion nimmt die Menge bzw. Konzentration des Katalysators im Lauf der Reaktion zu. Die Reaktion beschleunigt sich dabei selbst immer mehr. Sie wird erst langsamer, wenn die Edukte nahezu abreagiert haben.
c Die exotherme Reaktion ohne Kühlung sorgt für eine Beschleunigung durch Anstieg der Temperatur. Dadurch wird die pro Zeit freigesetzte thermische Energie vergrößert und die Heizrate steigt. Die Autokatalyse sorgt unabhängig davon für eine exponentielle Erhöhung der Reaktionsgeschwindigkeit. Beide Faktoren zusammen sorgen für einen plötzlichen Temperaturanstieg, der bis zur Siedetemperatur des Lösungsmittels geht. Die dann freigesetzte Energie verdampft das Lösungsmittel.
Aufgabe 3
a Der Stoff X wurden nicht langsam, sondern auf einmal zugegeben. Im Protokoll wird außerdem keine Kühlmaßnahme beschrieben.
b
– Das Reaktionsgefäß von außen und ggf. auch von innen kühlen und den Inhalt rühren, damit der Wärmeaustausch stattfinden kann.
– Die Temperatur der Reaktionsmischung messen. Weiteres X erst zugeben, wenn die Temperatur wieder auf den Ausgangswert gefallen ist.
c Vorteil: Das Lösungsmittel verdampft nicht bereits bei 45 °C und der Inhalt des Kolbens wird so ggf. nicht im Labor verteilt.
Nachteil: Wenn die Energie der Reaktion ausreicht, um eine Temperatur von 95 °C zu erreichen, dann ist mehr Energie in der Reaktionsmischung gespeichert, die wegen der Selbstbeschleunigung der Reaktion in noch kürzerer Zeit frei wird. Eine anschließende Verdampfung des Lösungsmittels wird noch schneller erfolgen und ggf. mehr Schaden anrichten.
rechte Spalte: Deacon-Verfahren
Aufgabe 1
a Kupferchlorid und Kupferoxid wirken als Katalysatoren, die im Verlauf der Reaktion ständig ineinander umgewandelt werden.
b \( {\rm 4\ HCl(g) + O_2(g)} \rightleftharpoons {\rm 2\ H_2O(g) + 2\ Cl_2(g)} \)
c \( {\rm K_C} = {\rm \frac {c^2(H_2O)\ ·\ c^2 (Cl_2)} {c^4(HCl)\ ·\ c(O_2)} } \)
\( {\rm [K_C]} = \frac {{\rm (mol\ ·\ l^{-1})^2}\ ·\ {\rm (mol\ ·\ l^{-1})^2}} {{\rm (mol\ ·\ l^{-1})^4}\ ·\ {\rm (mol\ ·\ l^{-1})}} = {\rm l · mol^{-1}} \)
________________________________________________________
Seite 59
Chemisches Gleichgewicht
Aufgabe 1
a \( {\rm K_C} = {\rm \frac{c(B)}{c(A)} } \)
Geeignete Konzentrationsdaten zur Berechnung von \( {\rm K_C} \) erhält man, wenn das System im Gleichgewicht ist, also bei t = 240 s.
Erste Messung: \( {\rm K_C} = \frac {0,67\ {\rm mol\ ·\ l^{-1}}} {0,33\ {\rm mol\ ·\ l^{-1}}} ≈ 2 \)
Zweite Messung: \( {\rm K_C} = \frac {0,60\ {\rm mol\ ·\ l^{-1}}} {0,40\ {\rm mol\ ·\ l^{-1}}} = 1,5 \)
b Die Gleichgewichtskonzentration des Produkts, c(B), ist größer als die des Edukts, c(A). Damit liegt das Gleichgewicht auf der Seite des Produkts.
c Bei der zweiten Messung stellt sich das Gleichgewicht schneller ein, die Gleichgewichtskonzentrationen verändern sich aber gegenüber der ersten Messung. Dieser Fall kann nur bei Temperaturerhöhung auftreten. Da die Gleichgewichtskonstante in der zweiten Messung, d.h. bei höherer Temperatur, kleiner ist, muss die Umwandlung von A in B gemäß des Prinzips von Le Chatelier exotherm sein.
Aufgabe 2
Die Konzentration von A ist nach der Störung größer als die Gleichgewichtskonzentration. Nach dem Prinzip von Le Chatelier wird durch Umwandlung von A in B c0(A) verkleinert und c0(B) vergrößert, bis der Konzentrationenquotient gleich Kc ist.
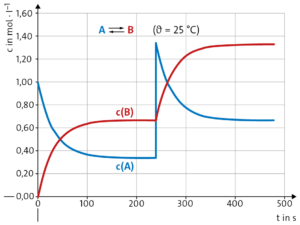
\( {\rm c_0(A)} = 1,33 {\rm mol · l^{-1}}; {\rm c_0(B)} = 0,67 {\rm mol · l^{-1}}; {\rm K_C} = 2 \)
\( {\rm K_C} = {\rm \frac{c(B)}{c(A)} } = \frac {{\rm c_0(B)\ +\ x}} {{\rm c_0(A)\ -\ x}} \)
\( {\rm K_C} · {\rm (c_0(A) – x)} = {\rm c_0(B)\ +\ x} \)
Klammer auflösen, Variable auf eine Seite bringen:
\( {\rm K_C · c_0(A) – c_0(B)} = {\rm x (K_C + 1)} \)
Teilen durch \( {\rm (K_C + 1)} \)
\( {\rm x} = \frac {{\rm K_C\ ·\ c_0(A) – c_0(B)}} {{\rm K_C + 1}} ≈ 0,67 {\rm mol · l^{-1}} \)
\( {\rm c(A)} = {\rm c_0(A) – x} = 0,67 {\rm mol · l^{-1}} \)
\( {\rm c(B)} = {\rm c_0(B) + x} = 1,33 {\rm mol · l^{-1}} \)
________________________________________________________
Seite 60
Chemisches Gleichgewicht in Natur und Technik
Aufgabe 1
a Fe(OH)2(s) \( \rightleftharpoons \) Fe2+(aq) + 2 OH–(aq)
Fe(OH)3(s) \( \rightleftharpoons \) Fe3+(aq) + 3 OH–(aq)
b KL(Fe(OH)2) = c(Fe2+) ⋅ c2(OH–) = 1,6 ⋅ 10-15 mol3 ⋅ l-3
KL(Fe(OH)3) = c(Fe3+) ⋅ c3(OH–) = 5,0 ⋅ 10-38 mol4 ⋅ l-4
Aufgabe 2
a c(Fe2+) und c(Fe3+) werden über das Löslichkeitsprodukt durch c(OH–) limitiert:
\( {\rm c(Fe^{2+})} = {\rm \frac {K_L(Fe(OH)_2)} {c^2(OH^-)} ; c(Fe^{3+}) } = {\rm \frac {K_L(Fe(OH)_3)} {c^3(OH^-)} } \)
Aus den gegebenen Konzentrationen der Hydroxid-Ionen in Magen und Darm und den jeweiligen Löslichkeitsprodukten ergibt sich:
c(Fe2+, Magen)max = 1,6 ⋅ 1011 mol ⋅ l-1.
Dieser Wert ist eine reine Rechengröße und kann nie erreicht werden. c(Fe2+, Darm)max = 0,0016 mol ⋅ l-1
c(Fe3+, Magen)max = 50 mol ⋅ l-1.
Dieser Wert ist eine reine Rechengröße und kann nie erreicht werden.
c(Fe3+, Darm)max = 5 ⋅ 10-20 mol ⋅ l-1.
Der Darm limitiert die Konzentration der Eisen-Ionen. Vor allem gelöste Fe3+-Ionen sind im Darm so gut wie nicht vorhanden.
b Fe2+-Ionen können im Darm in einer deutlich höheren Konzentration vorliegen als Fe3++-Ionen, wodurch ihre resorbierte Menge viel größer ist. Pflanzliche Nahrungsmittel, die von Vegetariern gegessen werden, enthalten nur Fe3+-Ionen. Durch die Reduktion der Fe3+-Ionen mit Ascorbinsäure zu Fe2+-Ionen entstehen aber auch hier ausreichende Mengen resorbierbarer Eisen-Ionen.
________________________________________________________
Seite 61
Grüner Wasserstoff – eine Hilfe für kalkbildende Muscheln?
Aufgabe 1
Windkraft, Sonnenenergie, Biomasse und Wasser sind die Träger erneuerbarer Energie. Sie können zur Erzeugung von „grünem Strom“ genutzt werden, der wiederum für die Elektrolyse von Wasser verwendet wird. Wasser (H2O) wird mithilfe des grünen Stroms elektrolysiert, wobei das Wasser in die Elemente Wasserstoff (H2) und Sauerstoff (O2) zerlegt wird. Wasserstoff, eigentlich ein farbloses Gas, wird als „grüner Wasserstoff“ bezeichnet, wenn bei der Produktion ausschließlich Strom aus erneuerbaren Energiequellen zum Einsatz kommt. Der so gewonnene grüne Wasserstoff wird dann für die Nutzung über Tankwagen, Pipelines und per Schiff transportiert. Unabhängig von der gewählten Elektrolysetechnologie erfolgt die Produktion von Wasserstoff CO2-frei, da der eingesetzte Strom zu 100 % aus erneuerbaren Quellen stammt und damit CO2-frei ist.
Der grüne Wasserstoff wird beispielsweise zur Gewinnung von Strom und Wärme, für Brennstoffzellenantriebe in Kraftfahrzeugen, als Dieselersatz für den Antrieb von Fahrzeugen, als Rohstoff, z. B. für die Produktion von Kunststoffen, oder als Brennstoff in der Industrie genutzt.
Aufgabe 2
a Beim Lösen von CO2 in Wasser spielen folgende Gleichgewichte eine Rolle:
CO2(g) \( \rightleftharpoons \) CO2(aq) (1)
H2O(l) + CO2(aq) \( \rightleftharpoons \) H2CO3(aq) (2)
H2CO3 (aq) + H2O (l) \( \rightleftharpoons \) HCO3- (aq) + H3O+(aq) (3)
HCO3- (aq) + H2O (l) \( \rightleftharpoons \) CO32- (aq) + H3O+(aq) (4)
Das Wasser im Meer ist leicht alkalisch, d. h., es enthält Hydroxid-Ionen OH–(aq). Deshalb reagieren im Meerwasser Oxonium-Ionen H3O+(aq) mit den vorhandenen Hydroxid-Ionen. Entsprechend dem Prinzip von Le Chatelier verschieben sich die Gleichgewichte (2), (3) und (4) daher auf die rechte Seite. Daraus folgt, dass im leicht alkalischen Oberflächenwasser vergleichsweise viele Carbonat-Ionen vorliegen.
Muschelschalen bestehen aus Kalk (Calciumcarbonat, CaCO3). Die Löslichkeit (bzw. Bildung) von Calciumcarbonat wird durch folgendes Gleichgewicht bestimmt:
CaCO3(s) \( \rightleftharpoons \) Ca2+(aq) + CO32-(aq) | exotherm (6)
Bei hohen Konzentrationen an Carbonat-Ionen liegt das Gleichgewicht (6) auf der linken Seite, das Lösen von Calciumcarbonat bleibt aus. Auch die Bildung der Muschelschalen ist im leicht alkalischen Oberflächenwasser, in dem die Muscheln leben, unproblematisch, da das Wasser genügend Calcium-Ionen und Carbonat-Ionen enthält.
b Muschelschalen bestehen aus Kalk (Calciumcarbonat, CaCO3). Für die Bildung der Muschelschalen nehmen Muscheln Calcium-Ionen (Ca2+) direkt aus dem Meerwasser auf und transportieren sie über spezielle Proteine zur Schale. Dort reagieren sie mit Carbonat-Ionen (CO32-) aus dem Meerwasser zu Calciumcarbonat. Auf diese Weise wächst die Muschelschale. Die Bildung (bzw. Auflösung) von Calciumcarbonat wird durch das Gleichgewicht (6) bestimmt.
Bei einer zunehmenden Versauerung erhöht sich die Konzentration an Oxonium-Ionen im oberflächennahen Meereswasser. Nach dem Prinzip von Le Chatelier verschieben sich daher die vier Gleichgewichte (1), (2), (3), und (4) auf die linke Seite. Die Konzentration an Carbonat-Ionen wird dadurch im oberflächennahen Wasser verringert.
Durch die Verringerung der Konzentration an Carbonat-Ionen stehen nicht nur weniger Carbonat-Ionen für die Bildung von Calciumcarbonat zur Verfügung, sondern das Löslichkeitsgleichgewicht von Calciumcarbonat (6) verschiebt sich gemäß dem Prinzip von Le Chatelier auch noch nach rechts. Es kommt daher auch zum Abbau von Calciumcarbonat und damit auch zum Abbau der Kalkgehäuse.
Aufgabe 3
Die Löslichkeit von Calciumcarbonat wird durch folgendes Gleichgewicht bestimmt:
CaCO3(s) \( \rightleftharpoons \) Ca2+(aq) + CO32-(aq) | exotherm
Durch den erhöhten Druck und die geringeren Temperaturen nimmt die Löslichkeit von Calciumcarbonat nach dem Prinzip von Le Chatelier zu. Das Gleichgewicht verschiebt sich auf die rechte Seite. Es bilden sich unter dem Abbau von Calciumcarbonat vermehrt Calcium-Ionen und Carbonat-Ionen.
Das Tiefenwasser weist zudem infolge von biologischen Abbauprozessen eine besonders hohe Konzentration an gelöstem Kohlenstoffdioxid CO2(aq) auf. Calciumcarbonat reagiert mit dem gelösten Kohlenstoffdioxid gemäß folgender Reaktionsgleichung:
CaCO3(s) + H2O(l) + CO2(g) \( \rightleftharpoons \) 2 HCO3-(aq) + Ca2+(aq)
Die hohe Konzentration an Kohlenstoffdioxid im Tiefenwasser beeinflusst die Lage des Gleichgewichts und fördert den Abbau von Calciumcarbonat. Es kommt zum Abbau der kalkhaltigen Muschelschalen. Daher sind am Boden des Ozeans keine Muschelschalen zu finden.
Aufgabe 4
Grüner Wasserstoff trägt dazu bei, dass der anthropogene Kohlenstoffdioxidausstoß vermindert wird. Damit könnte langfristig weniger Kohlenstoffdioxid in die Atmosphäre gelangen und der CO2-Gehalt der Atmosphäre würde abnehmen. Wenn dieser Fall eintritt, so löst sich weniger CO2 im Meerwasser und die Gleichgewichte (2), (3) und (4) aus Teilaufgabe 2a verschieben sich wieder auf die linke Seite. In der Folge nimmt die Oxonium-Ionenkonzentration im oberflächennahen Meerwasser ab, das Wasser wird wieder alkalischer und es stehen mehr Carbonat-Ionen für die Bildung der Kalkschalen zur Verfügung.
Die Verwendung von grünem Wasserstoff kann diesen Prozess unterstützen. Dies gelingt jedoch nur, wenn durch viele Maßnahmen in Summe der anthropogen verursachte Kohlenstoffdioxidausstoß soweit reduziert würde, dass der CO2-Gehalt in der Atmosphäre sänke und wieder Konzentrationen annehmen würde, die vor dem massiven Anstieg des anthropogen verursachten Treibhauseffekts vorlagen.
© Cornelsen Verlag GmbH