Abitraining Chemie Klausur Leistungskurs 2
Thema: Korrosionsprobleme im Bootssport
Orientierungen zur Lösung
Aufgabe 1: Erklären Sie am Beispiel des Rostens von Eisen den Begriff Korrosion. Geben Sie die Reaktionsgleichungen für die beim Rosten von Eisen ablaufenden Reaktionen an. Erläutern Sie die Vorgänge der Sauerstoffkorrosion von Eisen bis zur Entstehung von Eisen(II)-hydroxid, auch indem Sie die Abbildung 2 (Anhang) durch Formeln und Teilgleichungen ergänzen.
Teil 1) am Beispiel des Rostens von Eisen den Begriff Korrosion erklären:
• Beim Rosten reagiert Eisen in Gegenwart von Feuchtigkeit (Wasser) mit Sauerstoff aus der Luft.
• Die Eisen-Atome werden zu Eisen-Kationen oxidiert, Sauerstoff-Moleküle werden mit Wasser-Molekülen zu Hydroxid-Ionen reduziert.
• Allgemein versteht man unter Korrosion Vorgänge, bei denen Gegenstände unter teilweiser oder vollständiger Auflösung mit Stoffen der Umgebung reagieren.
Teil 2) die Reaktionsgleichungen für die beim Rosten von Eisen ablaufenden Reaktionen angeben:
2 Fe + O2 + 2 H2O → 2 Fe(OH)2
4 Fe(OH)2 + O2 → 4 FeO(OH) + 2 H2O
Teil 3) die Vorgänge der Sauerstoffkorrosion von Eisen bis zur Entstehung von Eisen(II)-hydroxid erläutern:
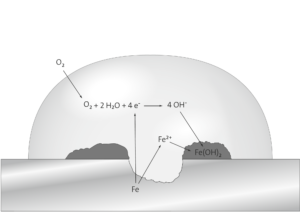
Die bei der Korrosion von Eisen abgegebenen Elektronen reduzieren Sauerstoff-Moleküle, welche mit Wasser-Molekülen zu Hydroxid-Ionen reagieren. Diese reagieren letztlich mit den Eisen(II)-Ionen zu Eisen(II)-hydroxid.
_____________________________________________________
Aufgabe 2: Skizzieren Sie einen möglichen experimentellen Aufbau zur Galvanisierung eines Eisenwerkstückes. Erläutern Sie anhand von Teilgleichungen für die beim Verzinken von Eisen ablaufenden Reaktionen den Prozess des Galvanisierens. Berechnen Sie die Stromstärke, bei der die Verzinkung der Ankerkette in Experiment 1 durchgeführt wurde.
Teil 1) einen möglichen experimentellen Aufbau zur Galvanisierung eines Eisenwerkstückes skizzieren:
Hier wird erwartet, dass der Prüfling den Versuchsaufbau unter Verwendung einer Zink(II)-Salzlösung, einer Zinkelektrode als Anode und dem Eisenwerkstück als Kathode nachvollziehbar zeichnet.
Teil 2) anhand von Teilgleichungen für die beim Verzinken von Eisen ablaufenden Reaktionen den Prozess des Galvanisierens erläutern:
Beim Galvanisieren findet eine Elektrolyse (erzwungene Redoxreaktion) statt. Als Elektrolyt wird eine Zink(II)-Salzlösung verwendet. Der zu galvanisierende Stoff wird als Kathode geschaltet, als Anode fungiert elementares Zink.
Teilgleichungen:
Kathode (Reduktion): Zn2+ + 2 e– → Zn
Anode (Oxidation): Zn → Zn2+ + 2 e–
Teil 3) die Stromstärke berechnen, bei der die Verzinkung der Ankerkette in Experiment 1 durchgeführt wurde:
m(Zn)= 80,654 kg – 80,000 kg = 0,654 kg = 654 g
n = m / M = 654 g / 65,4 g · mol-1 = 10 mol
4 Tage = 96 h = 5760 min = 345600 s
I · t = n · z · F
I = (10 mol · 2 · 96485 As · mol-1) / 345600 s = 5,58 A
_____________________________________________________
Aufgabe 3: Berechnen Sie die Spannung einer Konzentrationszelle aus der Vergleichshalbzelle und einer Halbzelle mit einer Probelösung, deren Konzentration dem Richtwert von 5,0 mg/L entspricht (Experiment 2). Erläutern Sie das Auftreten einer Spannung und begründen Sie anhand der Rechnung, wie sich die Spannung beim Überschreiten des Richtwertes ändert.
Teil 1) die Spannung einer Konzentrationszelle berechnen aus der Vergleichshalbzelle und einer Halbzelle mit einer Probelösung, deren Konzentration dem Richtwert von 5,0 mg · L-1 entspricht:
n = m / M = 0,005 g / 65,4 g · mol-1 = 0,000076 mol
U = E(Akzeptor) – E(Donator)
= (E0(Zn/Zn2+) + (0,059 V / 2) · lg (1))
– (E0(Zn/Zn2+) + (0,059 V / 2) · lg (0,000076))
= (–0,76V + 0 V) – (–0,76 V + (–0,121 V)) = 0,121 V
Teil 2) das Auftreten einer Spannung erläutern:
• Jedes Metall hat das Bestreben, in einer umgebenden Lösung Ionen zu bilden. Je niedriger die Ionen-Konzentration in der umliegenden Lösung, desto stärker ist die Lösungstendenz.
• In der Probelösung liegt eine sehr geringe Zink(II)-Ionen-Konzentration vor. Hierdurch bilden sich verhältnismäßig viele Zink(II)-Ionen. Die zurückbleibenden Elektronen laden die Zinkelektrode negativ auf. In der Vergleichshalbzelle findet dieser Prozess aufgrund des chemischen Gleichgewichtes viel weniger statt.
• Die beiden Halbzellen bilden unterschiedliche Potenziale aus. Die Halbzelle der Probelösung wird zum Minuspol, die Halbzelle der Vergleichslösung zum Pluspol.
• Beim Verbinden der beiden Halbzellen fließen Elektronen von der Halbzelle mit der Probelösung zur Halbzelle mit der Vergleichslösung. Deren Triebkraft ist als Potenzialdifferenz bzw. als Spannung messbar.
Teil 3) anhand der Rechnung begründen, wie sich die Spannung beim Überschreiten des Richtwertes ändert:
Beim Erhöhen der Zink(II)-Ionen-Konzentration nähern sich die beiden Konzentrationen der Konzentrationszelle an. Die Spannung wird kleiner. Sobald die Spannung den Wert von 0,121 V unterschreitet, ist der Richtwert überschritten.
_____________________________________________________
Aufgabe 4: Erläutern Sie die Beobachtungen bei Experiment 3 auch mithilfe von Teilgleichungen. Erläutern Sie vor dem Hintergrund der Beobachtungen den Begriff „Opferanode“ und diskutieren Sie die Rahmenbedingungen, die zum Schutz des Eisens mit dieser Methode gewährleistet sein müssen.
Teil 1) die Beobachtungen bei Experiment 3 auch mithilfe von Reaktionsgleichungen erläutern:
• Da in a) eine Blaufärbung zu beobachten ist, müssen im Gegensatz zu b) Eisen(II)-Ionen in Lösung gegangen sein.
Fe → Fe2+ + 2 e–
• Der weiß-gelbliche Niederschlag zeigt die Bildung von Zn2+-Ionen an.
Zn → Zn2+ + 2 e–
• Die purpurne Verfärbung in a) und b) zeigt die Entstehung von Hydroxid-Ionen an.
2 H2O + O2 + 4 e– → 4 OH–
Teil 2) vor diesem Hintergrund der Beobachtungen den Begriff „Opferanode“ erläutern:
Zink „opfert“ sich im gebildeten Lokalelement für das edlere Eisen und gibt Elektronen über das Eisen ab. Als Folge zersetzt sich lediglich das Zinkstück und der Eisennagel bleibt unverändert.
Teil 3) die Rahmenbedingungen diskutieren, die zum Schutz des Eisens mit dieser Methode gewährleistet sein müssen:
– Eisen und Zink müssen leitend miteinander verbunden sein.
– Eisen und Zink müssen sich in einem gemeinsamen Elektrolyten befinden.
– Sobald das komplette Zink oxidiert ist, endet die Schutzwirkung.