Abitraining Chemie Klausur Grundkurs 6
Thema: Carmoisin – Synthese und Einsatz als Lebensmittelfarbstoff
Orientierungen zur Lösung
________________________________________________
Aufgabe 1: Geben Sie die Kennzeichen aromatischer Systeme an. Erläutern Sie anhand der Molekülstrukturen das unterschiedliche Verhalten von Stoff A (Naphthalin) und Stoff B (1,2,3,4,5,8-Hexahydronaphthalin) gegenüber Brom. Erläutern Sie den Ablauf der Reaktion von Stoff B und Brom in Einzelschritten.
Teil 1) die Kennzeichen aromatischer Systeme angeben:
– planares Ringsystem
– delokalisiertes π-Elektronensystem
– Mesomeriestabelisierung
– Hückel-Regel (alternativ: [4n + 2] π-Elektronen)
Teil 2) anhand der Molekülstrukturen das unterschiedliche Verhalten von Stoff A und Stoff B gegenüber Brom erläutern:
Stoff A (Naphthalin) ist eine aromatische Verbindung mit delokalisiertem π-Elektronensystemen, die aufgrund des Energiegewinns durch
Mesomerie energieärmer und stabiler ist.
Eine elektrophile Addition von Brom an den Aromaten kann aufgrund der Mesomeriestabilisierung nicht erfolgen.
Bei Stoff B liegen isolierte Doppelbindungen vor, die leichter elektrophil angreifbar sind. Bei Raumtemperatur erfolgt eine elektrophile Addition der Brom-Moleküle an die Doppelbindungen.
Teil 3) den Ablauf der Reaktion von Stoff B und Brom in Einzelschritten erläutern:
⇒ auf die typischen Schritte einer elektrophilen Addition eingehen:
Schritt 1:
– ein Brom-Molekül nähert sich an die C=C-Doppelbindung an mit temporärer Polarisierung der Elektronenpaarbindung
– Wechselwirkung des positiv teilgeladenen Brom-Atoms und der Doppelbindung (Tradukt)
– heterolytische Trennung der Bindung des Brom-Moleküls und Bildung eines Bromonium-Ions (Interdukt) und eines Bromid-Ions
Schritt 2:
– Anlagerung eines Bromid-Ions am Bromonium-Ion (Bildung einer 1,2-Dibromverbindung)
________________________________________________
Aufgabe 2: Geben Sie Reaktionsgleichungen und den Reaktionstyp für die Sulfonierung von 1-Naphthol und 1-Aminonaphthalin an. Erläutern Sie die unterschiedliche Löslichkeit von 4-Hydroxynaphthalin-1-sulfonsäure in Natronlauge und in stark saurer Lösung. Erläutern Sie unter Angabe des Reaktionstyps den Ablauf der Reaktion von 4-Hydroxynaphthalin-1-sulfonat-Ionen und Diazonium-Ionen zu Carmoisin-Molekülen (Schritt III) in Einzelschritten.
Teil 1) Reaktionsgleichungen und den Reaktionstyp für die Sulfonierung von 1-Naphthol und 1-Aminonaphthalin angeben:
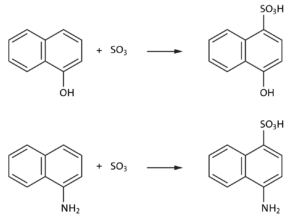
Reaktionstyp: elektrophile Addition
Teil 2) die unterschiedliche Löslichkeit von 4-Hydroxynaphthalin-1-sulfonsäure in Natronlauge und in stark saurer Lösung erläutern:
• 4-Hydroxynaphthalin-1-sulfonsäure-Moleküle enthalten ein unpolares Naphthalin-
Grundgerüst und jeweils eine polare Sulfonsäuregruppe und eine polare Hydroxygruppe.
• In stark saurer Lösung liegen ungeladene Moleküle vor, der unpolare Anteil der
Moleküle überwiegt.
• In Natronlauge kommt es an der Sulfonsäure- und der Hydroxygruppe jeweils zu
einer Säure-Base-Reaktion; die Sulfonsäure- und die Hydroxygruppen reagieren
als Säure, die Wasserstoff-Atome dieser Gruppen werden als Protonen abgespalten
und reagieren mit den Hydroxid-Ionen der Lauge zu Wasser-Molekülen.
• Aufgrund der in Natronlauge vorliegenden Ladungen (SO3–- und O–-Gruppen)
sind stärkere Wechselwirkungen mit Wasser-Molekülen möglich, die Löslichkeit
der Verbindung in Natronlauge ist gegenüber der Löslichkeit in stark saurer
Lösung erhöht.
Teil 3) unter Angabe des Reaktionstyps den Ablauf der Reaktion der 4-Hydroxynaphthalin-1-sulfonat-Ionen und der Diazonium-Ionen zu Carmoisin-Molekülen (Schritt III) in Einzelschritten erläutern:
Reaktionstyp: elektrophile Substitution (auch möglich: Azokupplung)
– elektrophiler Angriff der Diazonium-Ionen
– Bildung eines π-Komplexes und Bildung des mesomeriestabilisierten σ-Komplexes
– Rearomatisierung
________________________________________________
Aufgabe 3: Erklären Sie am Beispiel von Carmoisin unter Bezug auf Tabelle 1 und das angegebene Extinktionsmaximum den Zusammenhang zwischen Lichtabsorption und Farbigkeit. Begründen Sie anhand der Molekülstruktur die Farbigkeit von Carmoisin. Beurteilen Sie anhand der Molekülstruktur und der Eigenschaften den Einsatz von Carmoisin in Limonade.
Teil 1) am Beispiel von Carmoisin den Zusammenhang zwischen Lichtabsorption und Farbigkeit erklären:
Wichtige Punkte:
– Spektralfarben des weißen Lichts
– Anregung von Elektronen
– Energiestufenmodell der Lichtabsorption
– Extinktionsmaximum des angegebenen Farbstoffs
– Zusammenhang zwischen absorbierter Spektralfarbe und Eigenfarbe des Farbstoffs
⇒ Extinktionsmaximum von 516 nm beim Carmoisin, absorbierte Spektralfarbe Grün, Eigenfarbe Purpur
Teil 2) anhand der Molekülstruktur die Farbigkeit von Carmoisin begründen:
Wichtige Punkte:
– ausgedehntes System konjugierter Doppelbindungen (Chromophor)
– Mesomeriemodell, mesomere Grenzstrukturen, Delokalisation von konjugierten π-Elektronen
– Einfluss von Donator-/Akzeptorgruppen, hier z. B. der Hydroxygruppe als Donatorgruppe
Teil 3) anhand der Molekülstruktur und der Eigenschaften den Einsatz von Carmoisin in Limonade beurteilen:
Carmoisin besitzt geladene Sulfonatgruppen und eine polare Hydroxygruppe ⇒ gut wasserlöslich
Weitere Eigenschaften: beständig gegen Fruchtsäuren, Licht und Hitze ⇒ gut geeignet für den Einsatz in Limonade
Carmoisin ist aber ein synthetisch hergestellter Farbstoff (gehört zu Azofarbstoffen); kann die Aktivität und Aufmerksamkeit
bei Kindern beeinträchtigen
Beim Verzehr carmoisinhaltiger Lebensmittel muss die Einhaltung des ADI-Wertes beachtet werden.
⇒ Aus diesen Gründen sollte auf den Einsatz von Carmoisin in Limonade verzichtet werden.