Kohlenstoff-Atome weisen eine Besonderheit auf
Kohlenstoff-Atome besitzen vier Valenzelektronen und können mit diesen Elektronenpaarbindungen zu vielen weiteren Kohlenstoffatomen eingehen. Je nachdem ob alle vier oder nur drei Valenzelektronen für die Ausbildung von Elektronenpaarbindungen genutzt werden, findet man völlig unterschiedliche Erscheinungsformen von Kohlenstoff, z. B. die in der Natur vorkommende Modifikationen Diamant und Graphit.
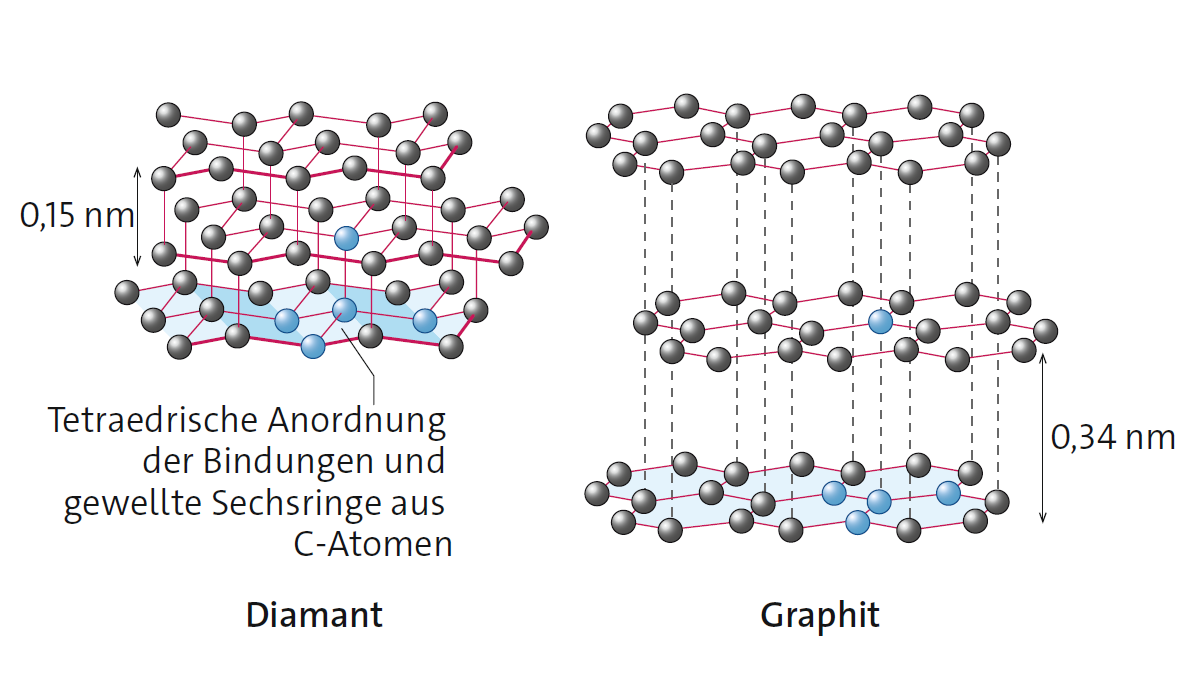
Struktur und Eigenschaften von Diamant
Im Diamant gehen die vier Valenzelektronen eines Kohlenstoff-Atoms Elektronenpaarbindungen mit vier weiteren Kohlenstoff-Atomen ein. Die vier Elektronenpaarbindungen sind tetraedrisch angeordnet, sodass ein dreidimensionales Kristallgitter aus gewellten Sechsringen entsteht. Alle Valenzelektronen sind in den Bindungen lokalisiert. Aus dieser Struktur resultieren folgende Eigenschaften des Diamanten:
- Diamant leitet nicht den elektrischen Strom.
- Diamant ist extrem hart.
- Diamant besitzt eine extrem hohe Schmelztemperatur (3550 °C).
Struktur und Eigenschaften von Graphit
Im Graphit bilden nur drei der vier Valenzelektronen Elektronenpaarbindungen zu anderen Kohlenstoff-Atomen aus. Die Struktur unterscheidet sich deshalb von der des Diamanten: Das Graphitgitter besteht aus ebenen, wabenartigen Schichten, die aus Sechsringen aufgebaut sind. Das vierte Valenzelektron ist zwischen diesen Schichten frei beweglich, es ist delokalisiert. Aus dieser Struktur resultieren folgende Eigenschaften des Graphit:
- Graphit leitet den elektrischen Strom parallel zu den Schichten.
- Graphit ist sehr weich. Weil zwischen den Schichten nur schwache Van-der-Waals-Kräfte wirken, können die Schichten gegeneinander verschoben werden (Graphitmine eines „Blei“stifts).