1.1.1 Zeichnung der Untersuchungsfläche
1.1.2 Schematische Darstellung möglicher Aufenthaltsorte bei kleinen Tieren
1.2 Messwerte ermitteln, benötige Messgeräte
1.3 Lebewesen bestimmen, sammeln und dokumentieren
1.3.2 Indirekter Nachweis lebender Mikroorganismen
1.3.6 Dokumentieren mit einer Fotogalerie
1.4 Messwerte ermitteln, Anleitungen
1.4.2 Temperatur und Luftfeuchte
1.4.3 Sickergeschwindigkeit des Bodens, relative Werte
1.4.5 Chemische Nachweise und Messungen
1.4.5.1 Kalkgehalt des Substrats
1.4.5.2 Katalase-Test mit Wasserstoffperoxid, H2O2
1.4.5.3 Nitratgehalt des Bodens
1.4.5.5 Verdunstung am Standort
1.5 Biologische Merkmale von Lebewesen
2 Thema Pflaster Grafiken sind neu zu zeichnen
3 Thema Mauer Grafik schon bei Cornelsen vorhanden
5.1.1 Methodische Erschließung
5.1.2 Vorbereitungen für die Freilandarbeit
5.1.2.1 Beispiel einer Auswertung
5.1.3 Geräte und Materialien für geplante Geländearbeiten
5.1.4 Übersicht der Deckungsgrade
5.1.5 Erfassung der Standortverhältnisse
5.1.8 Thema Gestörte Flächen ohne größere Trittbelastung
6.1 Beispiel ‚Invasive Arten‘ App ZOWIAC
6.2 Beispiel Observation international und Observation.org
1 Allgemeine Vorbereitungen
1.1 Karten ausdrucken
In einigen Bundesländern kann man kostenlos Katasterkarten abrufen. In NRW lautet die Adresse:
https://www.tim-online.nrw.de/tim-online2/
Es gibt ein Eingabefeld, in das man seine Adresse eingeben kann. Außerdem kann man sich die gezeichneten Karten oder eine fotografische Ansicht von oben anzeigen lassen. Den gewählten Kartenausschnitt kann man in verschiedenen Maßstäben bis zum Maßstab 1:5000 (Deutsche Grundkarte), alternativ mit oder ohne Höhenlinien, „downloaden“. Mit einem Bildbearbeitungsprogramm kann man die Karte für eigene Eintragungen nutzen. Es gibt gute kostenlose Programme. In manchen Städten ist die Verwaltung bereit, Kartenmaterial in Kopie zur Verfügung zu stellen.
1.1.1 Zeichnung der Untersuchungsfläche
Wenn man eine Fläche mit nicht einheitlichem Bewuchs hat, empfiehlt es sich, dies in einer Schemazeichnung festzuhalten. Diese eignet sich dazu, kleine Diagramme zu den Messwerten einzufügen.
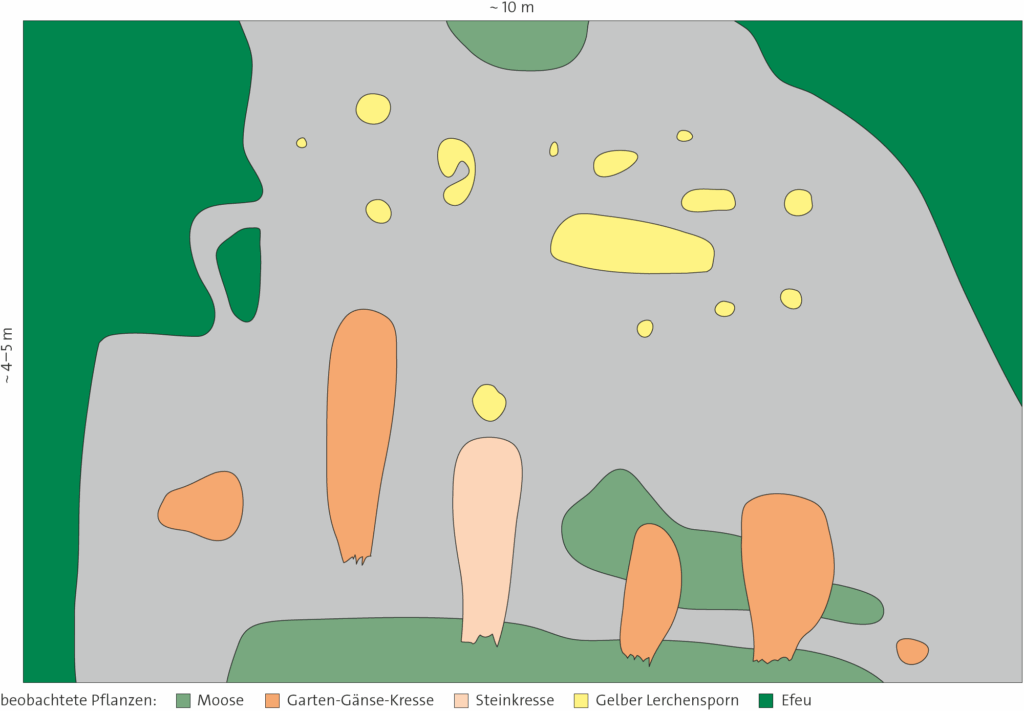
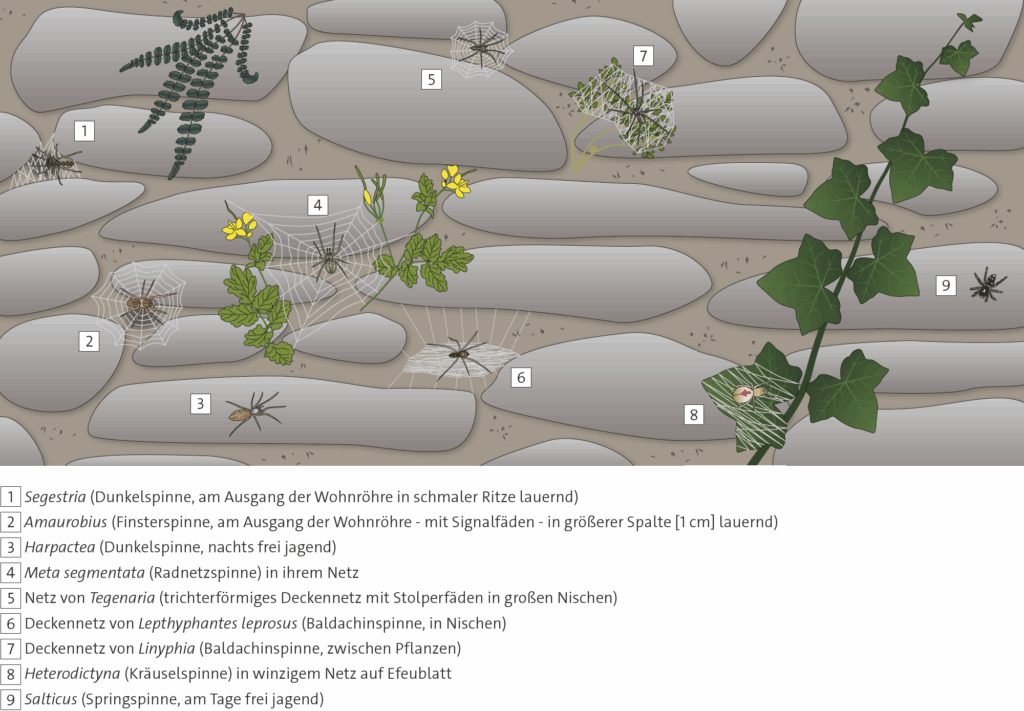
1.1.2 Schematische Darstellung möglicher Aufenthaltsorte bei kleinen Tieren
Am Beispiel von Spinnen an einer Bruchsteinmauer sind die Ergebnisse vieler Untersuchungen zusammengefasst. Zur Identifikation der Spinnen in einer Mauer besprüht man mit einer haushaltsüblichen Spritzflasche die vorhandenen Netze mit Wasser. Die ansonsten nicht gut sichtbaren Netze können deutlich unterschieden und dann beschrieben werden.
1.2 Messwerte ermitteln, benötige Messgeräte
- Lichtmessung mit einem Luxmeter
- Temperatur und Luftfeuchte mit einem kombinierten Messgerät, einem Thermo-/Hygrometer
- Wasserdurchlässigkeit des Bodens mit zwei Konservendosen und einer Stoppuhr
- Verdunstung am Standort mit einem Evaporimeter (Selbstbau, s.u.). Es liefert aussagekräftige Werte.
- Bodenfeuchte mit einer Waage und einem Trockenschrank oder nach Lufttrocknung
- Bodentemperatur mit einem Einsteckthermometer oder einem einfachen Laborthermometer
- Kalkgehalt des Bodens mit einer Tropfflasche mit verdünnter Salzsäure
- pH-Wert des Bodens mit einer Messelektrode oder Indikatorpapier. pH-Werte des Bodens liegen selten außerhalb des Bereiches von pH 8 bis pH 3. Beim Kauf der Indikatorpapiere sollte man darauf achten.
- Nitratgehalt des Bodens mit entsprechendem Nitrit-, Nitrat-Indikatorpapier
- Mit Selbstbauinstrumenten, die einen Microcontroller enthalten, lassen sich relativ kostengünstig Daten über einen längeren Zeitraum sammeln, zum Beispiel kann man einen Tagesgang der Temperatur Vor allem lohnt sich der Aufwand bei einem Thermo-/Hygrometer finanziell.
1.3 Lebewesen bestimmen, sammeln und dokumentieren
1.3.1 Bestimmen
Es gibt mittlerweile einige sehr gut funktionierende Applikationen (Apps) für Smartphones, mit deren Hilfe wildlebende Tiere, Pflanzen und Pilze bestimmt werden können.
Es werden Fotos oder Tonaufnahmen ausgewertet.
Die Nutzung ist kostenfrei bei den folgenden Apps:
- Obsidentify, eine durch öffentliche Mittel und durch eine Stiftung finanzierte kostenlose Software. Observe und Identify wurden zu einem Kofferwort zusammengezogen.
Es reicht häufig aus, ein einziges Foto zu machen. Selfies sind zwecklos und unerwünscht. Menschliche Individuen werden nicht erkannt. Wildlebende Pflanzen, Tiere und Pilze werden erkannt. Man kann auch schon vorhandene Fotos in der App für die Artbestimmung öffnen. - Flora incognita, kostenfreie App, die zu einem Forschungsprojekt gehört. Sie wurde durch öffentliche Mittel gefördert. Die App erkennt wildlebende Pflanzen und auch Zier- und Gartenpflanzen. Incognita ist lateinisch und heißt unbekannt.
- BirdNet, kostenfreie Vogelstimmenerkennungssoftware aus der Technischen Universität Chemnitz. Zusätzlich werden Lautäußerungen von Menschen als solche meist richtig erkannt.
Achtung! Die Apps geben an, ob sie eine Art sicher oder nur mit einer bestimmten Wahrscheinlichkeit erkannt haben. Pflanzen können mit den Apps mit hoher Wahrscheinlichkeit korrekt bestimmt werden. Wenn sich die App nicht sicher ist, sollte man zusätzlich eine kundige Person oder ein klassisches Bestimmungsbuch aus der Biologiesammlung zu Rate ziehen. Solche Bücher enthalten weitere Informationen über die Arten.
1.3.2 Indirekter Nachweis lebender Mikroorganismen
Der Belebungsgrad eines Bodens kann durch den Katalase-Nachweis bestimmt werden, siehe 1.4.5.2. Viele Lebewesen produzieren Katalase, weil bei einigen Reaktionen in Zellen das für die Zelle giftige Wasserstoffperoxid gebildet wird. Katalase beschleunigt seinen Zerfall. Es entstehen die ungiftigen Stoffe Wasser und Sauerstoff. Bodenorganismen produzieren in ihren Zellen sehr viel Katalase und scheiden überschüssiges Enzym aus. Da es relativ stabil ist, kann es im Boden nachgewiesen werden. Ist die Reaktion heftig, sind viele Organismen an der Humusbildung beteiligt.
1.3.3 Sammeln
Zur Identifizierung von kleineren Lebewesen, zum Beispiel aus Mauerritzen, von Blättern von Pflanzen oder aus der Streu oder der oberen Bodenschicht, ist es häufig nötig, die Tiere aufzusammeln und mikroskopisch zu betrachten. Man kann dazu mit einfachem Laborgerät aus der Biologiesammlung einen Exhaustor bauen.
In vielen Sammlungen finden sich Handgebläse, mit denen man ansaugen kann, wenn man der Gaze nicht traut. Ansonsten saugt man am Mundstück. Die Tiere werden in den Zylinder gesaugt und können danach entnommen werden.
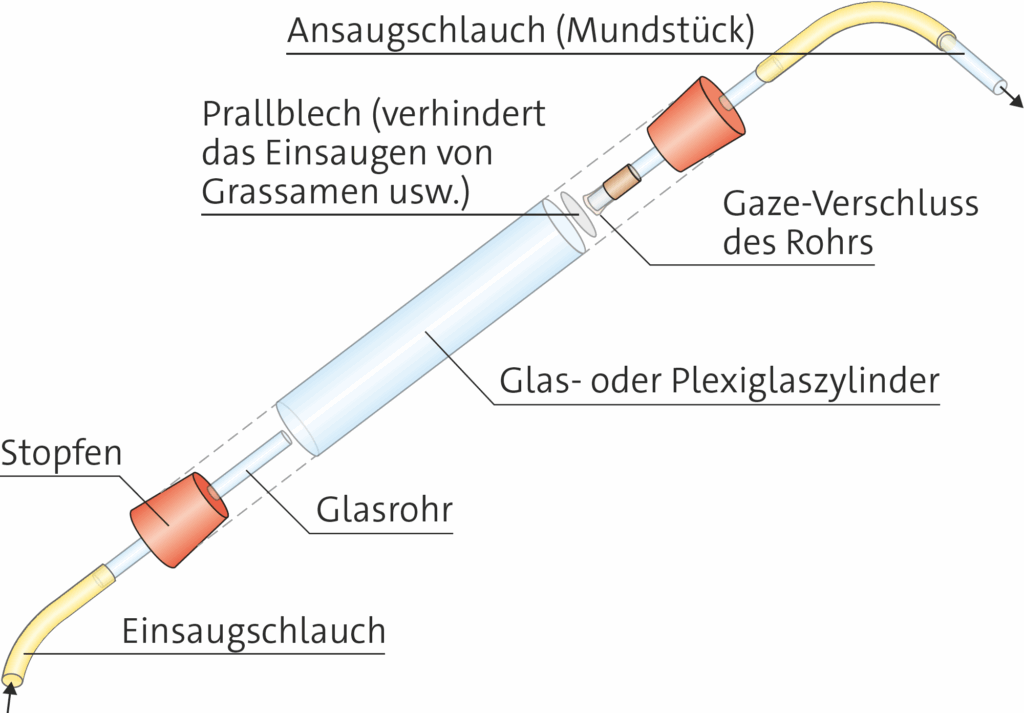
1.3.4 Extrahieren
Aus Moospolstern und aus der Streu kann man Wirbellose in Sammelgefäße austreiben. Dabei gibt es Tierarten, die zwischen dem Substrat frei beweglich sind und solche, die auf einen Wasserfilm angewiesen sind, der sich bei genügend Feuchtigkeit zwischen den Substratteilchen ausbildet.
Je nachdem, welche Tiere gesucht werden, verfährt man unterschiedlich.
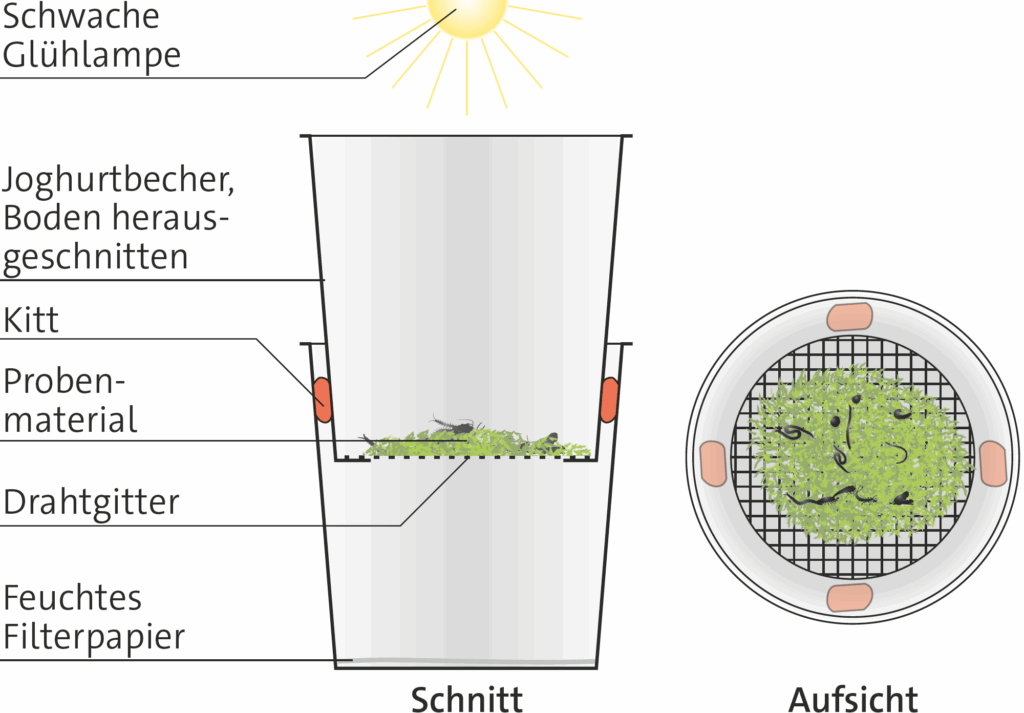
Kunststoffpetrischalen oder durchsichtige Kunststoffboxen, zum Beispiel solche, in denen Süßigkeiten verpackt werden, eignen sich als preiswerte Gefäße, in die Individuen vereinzelt werden können. Mit einem feinen Pinsel aus dem Malkasten kann man die Tiere schonend bewegen.
Schnappdeckelgläser kann man in verschiedenen Größen kaufen.
1.3.5 Mikroskopieren
Bei kleinen Tieren oder auch bei Blattquerschnitten muss man mit Binokularen oder Lichtmikroskopen betrachten, beobachten, bestimmen und dokumentieren. Dazu muss man die Lebewesen einsperren oder präparieren. Kleine Kammern kann man auf einem Objektträger mit Knetgummi abgrenzen und von oben mit einem Deckglas verschließen. Durch das Okular eines Mikroskops kann man mit der Smartphone Kamera gute Fotos erstellen.
1.3.6 Dokumentieren mit einer Fotogalerie
Mit heutigen Smartphones ist es ein Leichtes, eine gute Sammlung von Fotos der bestimmten Pflanzen und Tiere anzufertigen. Relativ günstig kann man dann ein gedrucktes Fotoalbum vom Projekt machen.
Hierin lassen sich einfach Bezüge zwischen den Arten und abiotischen sowie biotischen Faktoren eintragen.
Besonders wenn man Modifikationen untersucht, ist eine fotografische Gegenüberstellung zu empfehlen.
1.4 Messwerte ermitteln, Anleitungen
1.4.1 Beleuchtungsstärke
Für die meisten Zwecke wird ein Luxmeter genau lotrecht nach oben ausgerichtet. In kleinen Ritzen lässt sich mit Lichtsensoren arbeiten, deren Werte mit einem Microcontroller gelesen werden.
1.4.2 Temperatur und Luftfeuchte
Die Messgeräte oder -sonden benötigen zumeist Zeit, bis sie den richtigen Wert anzeigen. Das muss einmal ausprobiert werden und bei den Messungen beachtet werden. Bei Feuchtigkeitsmessungen ist Luftzug zu vermeiden, falls möglich. Wenn man Laborthermometer benutzt, muss man sie vor direkter Sonneneinstrahlung schützen. Das ist möglich, wenn man in Richtung Sonne ein Stück Aluminiumfolie vor das Thermometer hält, das das Thermometer nicht berührt. Auch Digitalthermometer und Hygrometer müssen vor direkter Sonnenstrahlung geschützt werden.
Es gibt Edelstahlthermometer, die man in den Boden stecken kann. Ihre Werte werden meistens analog angezeigt.
1.4.3 Sickergeschwindigkeit des Bodens, relative Werte
Der Boden wird von Auflagen und so weit es geht von Bewuchs befreit. Die oben und unten geöffneten Konservendosen (ca. 1 l) werden vorsichtig mit einem Hammer in den Boden geschlagen. Falls dies nicht möglich ist, wird der untere Rand der Dose zu den Seiten abgedichtet, zum Beispiel mit feuchtem Lehm oder mit Knetgummi. Eine Dose wird in offensichtlich lockeren Boden eingeschlagen, die andere in einen verdichteten Boden. In jede Dose wird ein Liter Wasser gegossen und es wird die Zeit gemessen, bis alles Wasser versickert ist. Falls dies, zum Beispiel bei einer gepflasterten Fläche, zu lange dauert, misst man weniger Wasser ab.
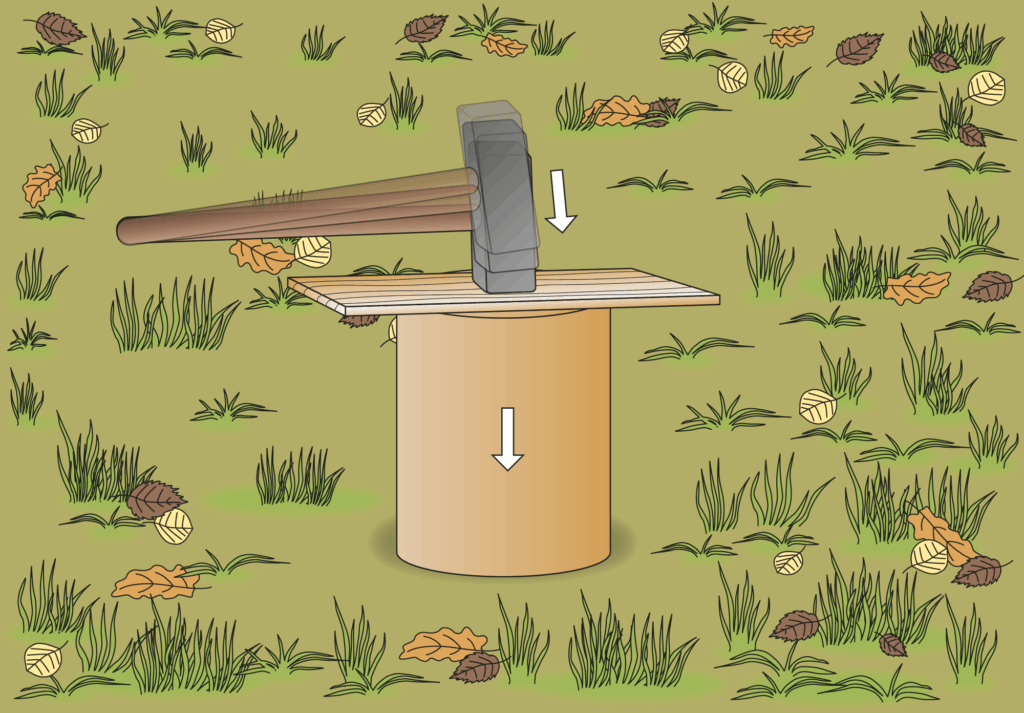
Da die Konservendosen beim Hineinklopfen in den Boden leicht kaputtgehen, sollten genügend zur Reserve bereitgehalten werden oder man greift auf stabilere Metallzylinder oder auch Kunststoffabflussrohre aus dem Baumarkt zurück, die beim Einklopfen recht stabil sind.
Die Sickergeschwindigkeit ist hoch, wenn der Boden durch Gänge von Regenwürmern und durch grobes Bodenmaterial viele Hohlräume besitzt. Dann wird die Bodenschicht gut belüftet. In verdichtetem Boden können nicht alle Pflanzenarten keimen. Samen, die nur im Dunkeln keimen, gelangen nicht in eine tiefere Bodenschicht, wenn der Boden oberflächlich dicht ist und nicht so einfach umgeschichtet werden kann. Dichter Boden fördert Lichtkeimer. Bei langsamem Versickern fließt Regenwasser oberirdisch ab, sodass der Boden schneller austrocknet.
1.4.4 Bodenfeuchte
Die Bodenfeuchte kann man für vegetationskundliche Zwecke einfach abschätzen. Es reicht die Einteilung in trocken, feucht und nass.
Wenn man genauere Werte haben möchte, muss man eine Bodenprobe, zur Erhaltung der aktuellen Bodenfeuchte in eine Plastiktüte eingepackt, mit in die Schule nehmen. Dort wird eine bestimmte Menge abgewogen, etwa 10 g. Diese wird in eine Porzellanschale gegeben, mit einem Papier abgedeckt und bei 105 °C im Trockenschrank für eine Stunde getrocknet und danach wieder gewogen. Der Trockenverlust wird auf das ursprüngliche Gewicht der Probe bezogen und in Prozent angegeben. Man kann auch eine Probe nahe der Heizung 24 Stunden lang trocknen.
Es gibt auch Bodenfeuchtemessgeräte. Diese sind recht teuer. Um Aussagen über den Standort machen zu können, muss man die Bodenfeuchte bei verschiedenen Bedingungen messen, zum Beispiel nach Regenphasen oder nach längeren Trockenperioden.
1.4.5 Chemische Nachweise und Messungen
1.4.5.1 Kalkgehalt des Substrats
Materialien
- 1 Teelöffel (10 g) luftgetrocknete Erde ohne Pflanzen und Tiere
- Salzsäure 10 %
- Petrischale, Tropfpipette
Durchführung
- Einen Teelöffel Erde in die Petrischale füllen, einige ml Salzsäure darauf tropfen und die Stärke des Aufbrausen und Geruch ermitteln.
- Auf Gestein oder Mörtel kann man an Ort und Stelle die Salzsäure darauf tropfen.
Ergebnis
Die Salzsäure setzt die Kohlensäure aus ihren Salzen frei: CaCO3 + 2 HCl → CaCl2 + CO2 + H2O
Unter mehr oder weniger stark anhaltendem Aufbrausen entweicht das Kohlenstoffdioxid.
Aus der Dauer und Stärke des Aufbrausens lässt sich auf den Kalkgehalt des Bodens schließen:
| Kalkgehalt im Boden | Stärke des Aufbrausens | |
| unter 1 % | kein Aufbrausen | |
| 1 % – 2 % | schwaches Aufbrausen | |
| 3 % – 4 % | starkes Aufbrausen, aber nicht anhaltend | |
| über 5 % | starkes, lang anhaltendes Aufbrausen | |
Entsteht Schwefelwasserstoffgeruch nach faulen Eiern, befinden sich Sulfide im Boden.
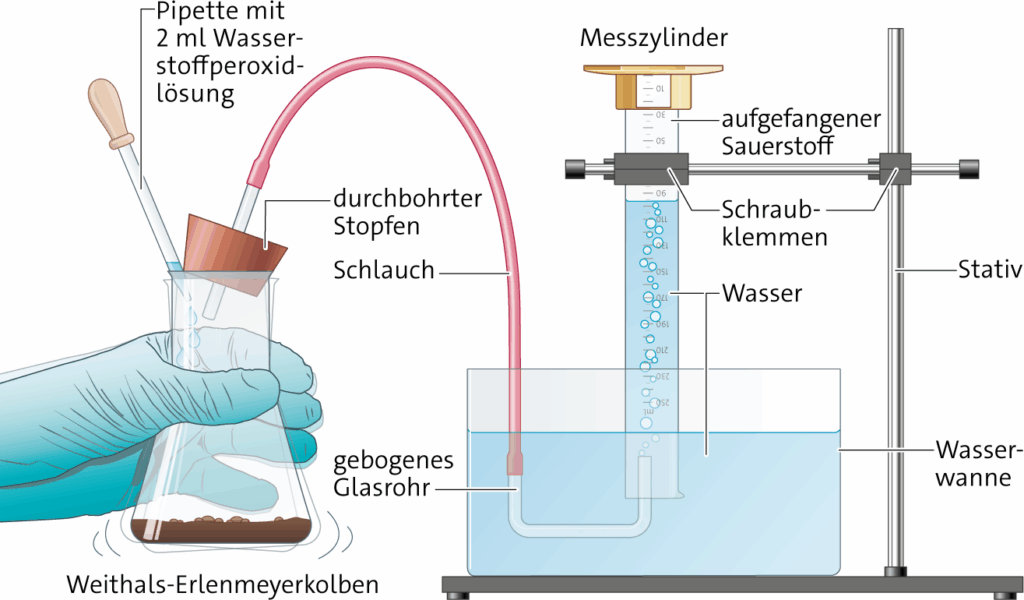
1.4.5.2 Katalase-Test mit Wasserstoffperoxid, H2O2
| Stoff | Gefahren | R- und S-Sätze |
| Wasserstoffperoxid w =3 % | Xi: reizend | R36/38 S3-28.1-36/39-45 |
Das Substrat aus Pflasterritzen, Mauerfugen oder unter Pflastersteinen kann ebenfalls getestet werden.
| Katalasewert (ml O2/min) |
Bodenbeurteilung |
| 0 – 5 | sehr schlecht (5) |
| 6 – 14 | schlecht (4) |
| 15 – 25 | befriedigend (3) |
| 26 – 49 | gut (2) |
| 50 und höher | sehr gut (1) |
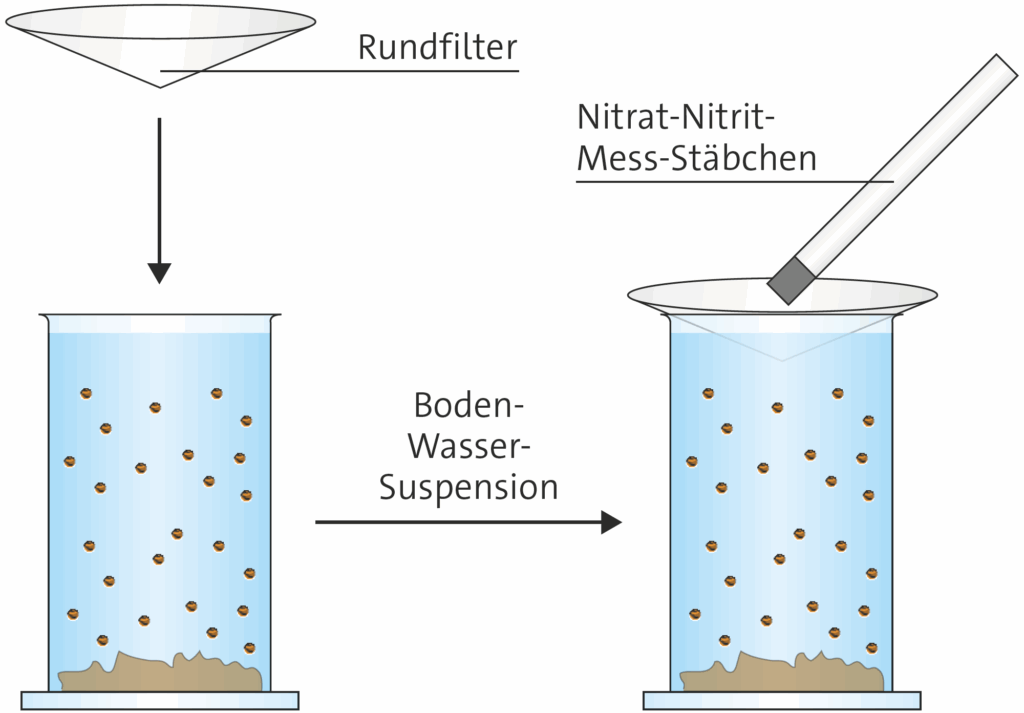
1.4.5.3 Nitratgehalt des Bodens
Der Nitratgehalt des Bodens kann quantitativ bestimmt werden. Dann ist es wichtig, dass man die Bodenschicht untersucht, in der die Pflanzenwurzeln das Nitrat entnehmen. Außerdem muss der gemessene Wert noch in einen vergleichbaren Wert pro kg Boden umgerechnet werden. Für die Bewertung des Standortes reicht es aus, aus 0 cm bis 30 cm Bodentiefe zum Beispiel mit dem Spaten eine Probe zu nehmen, den Boden zu mischen und dann 30 g davon abzuwiegen, für die man den Nitratgehalt ermittelt. Zur Extraktion des Nitrats aus dem Boden nimmt man eine Kaliumchloridlösung.
Chemikalien
- gesättigte Kaliumchlorid-Lösung: 30 g KCl auf 1 L dem. Wasser
Geräte
- Spaten
- Waage
- Nitrat-Nitrit-Teststäbchen (0 bis 500 mg/l)
- Rundfilter
- 200 ml Becherglas
Durchführung:
- 30 g Boden werden im Becherglas eingewogen und mit 120 ml Kaliumchloridlösung versetzt.
- Nach dem Verrühren wird von oben ein Rundfilter eingetaucht.
- Durch Filtration von außen (siehe Abbildung) nach innen wird im Inneren eine klare Flüssigkeit sichtbar.
- In das klare Filtrat wird ein Nitrat-Nitrit-Teststäbchen gesteckt, leicht abgeschüttelt und nach 1 Minute mit der Farbskala verglichen.
- Nun kann man die Werte der Böden von verschiedenen Stellen miteinander vergleichen.
Trotz der erhaltenen Messwerte kann man lediglich relative Angaben über die Verfügbarkeit von Stickstoff für das Wachstum der vorhandenen Pflanzen sagen. Dies gilt außerdem nur bei vergleichbarem pH-Wert. Unter pH 5 liegt mineralischer Stickstoff vermehrt als Ammonium, nicht als Nitrat vor.
Dennoch lohnt es sich, die Messwerte mit den Angaben zu Zeigerwerten zu vergleichen.
Eine biologisch vollständige Analyse von Messwerten und Pflanzenvorkommen kann man auf der Website „natur-erforschen“ von Dr. Heinrich Blana nachlesen.
Das C/N-Verhältnis eines Bodens gibt an, wie viel organisches Material, als Kohlenstoffgehalt gemessen, und wie viel pflanzenverfügbarer Stickstoff im Verhältnis zueinander vorhanden sind. Wenn dieses Verhältnis groß ist, wird wenig organisches Material von Mikroorganismen abgebaut, also auch wenig mineralisiert. Die Nährstoffversorgung für die Pflanzen ist schlecht.
Die Pflanzen, die in der Brennnesselgruppe zusammen gefasst werden, leben alle bei sehr hohen pflanzenverfügbaren Bodenstickstoffgehalten, was an der Verteilung in dem untersuchten Gebiet gut zu erkennen ist.
Wenn man lediglich Nitratgehalte misst, bleibt die Bewertung des Bodens unvollständig. Deshalb sind diese Werte für Vergleiche von Standorten nur eingeschränkt brauchbar.
1.4.5.4 pH-Wert des Bodens
Chemikalien
- demineralisiertes Wasser
- 5 mmol/l Calciumchloridlösung: 735 mg CaCl2 · 2 H2O auf 1 l dem. Wasser
- 1 mol/l Kaliumchloridlösung: 74,5 g KCl auf 1 l demineralisiertes Wasser
Geräte
- Mehrere Evaporimeter mit Zaundraht
- Spritzflasche mit Wasser
- Filterpapiere mit 3 cm ⌀ Durchmesser
- Präpariernadel
- Wasserfester Stift
- Pipette oder Bürette mit Einteilung
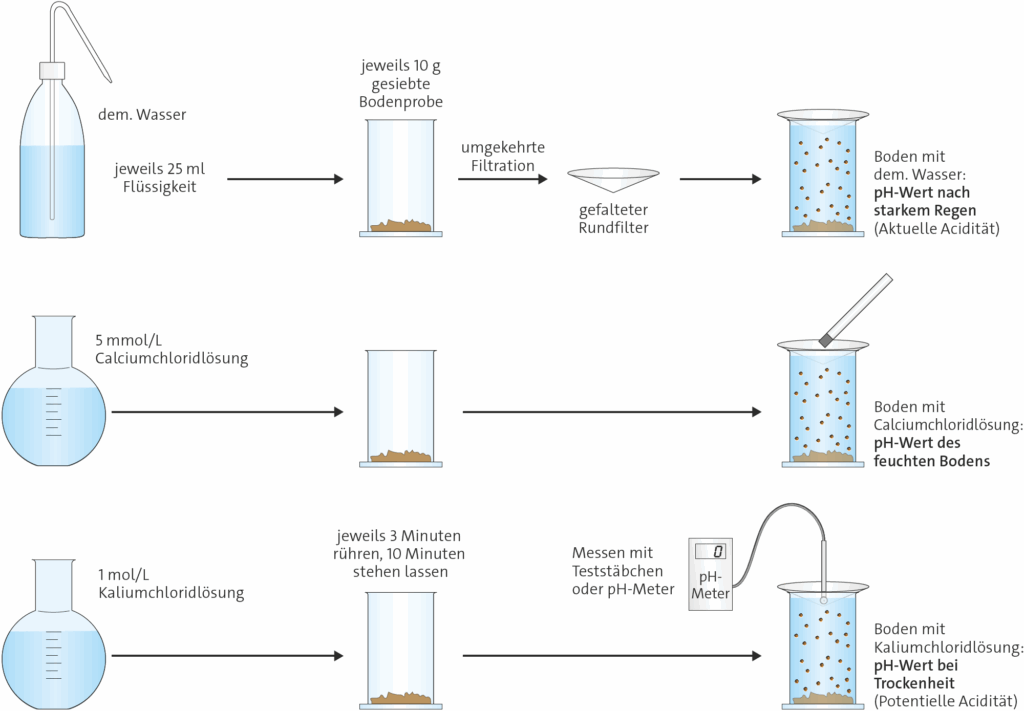
Die drei Extraktionslösungen sollen die jeweils angegebenen Situationen simulieren. Da Pflanzenwurzeln Kationen von Mineralstoffen häufig im Tausch gegen die Abgabe von H+-Ionen aufnehmen, wird dies bei trockenem Boden für die Pflanzen schwieriger als bei feuchtem Boden.
Die Aufnahme von Nitrat geschieht im Austausch mit der Abgabe von Hydroxid OH– und oder oder Hydrogencarbonat HCO3–. Das erhöht den pH-Wert lokal.
Bei niedrigen pH-Werten liegt Stickstoff vermehrt in Ammonium-Ionen und kaum noch in Nitrat-Ionen im Boden vor. Pflanzen, die lediglich Nitratstickstoff aufnehmen können, sind dann nicht existenzfähig.
Die Besenheide, Calluna vulgaris, kann dagegen nur Ammonium aufnehmen und kaum Nitrat. Sie wächst daher bevorzugt auf sauren Böden.
1.4.5.5 Verdunstung am Standort
Das im Boden vorhandene Wasser hat Einfluss auf die Wasseraufnahme einer Pflanze. Die Verdunstung von Wasser kann den Wasserbedarf einer Pflanze steigern, wenn sie sich dagegen nicht wehren kann, zum Beispiel durch das Schließen von Spaltöffnungen. Moose trocknen an Stellen mit hoher Verdunstung aus.
Zur Beurteilung von Standorten kann man daher die Verdunstung, die Evaporation, messen.
Geräte
- Mehrere Evaporimeter mit Zaundraht
- Spritzflasche mit Wasser
- Filterpapiere mit 3 cm ⌀ Durchmesser
- Präpariernadel
- Wasserfester Stift
- Pipette oder Bürette mit Einteilung
Das Messgerät, ein Evaporimeter, kann man in größerer Anzahl selbst herstellen. So gelingt es auch, einen Transekt zu vermessen.
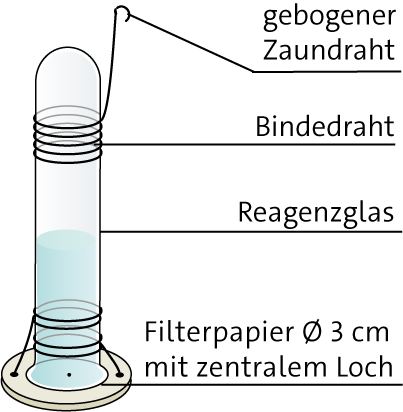
Um das Gerät im Gelände aufzuhängen, nimmt man als Stativ steifen Zaundraht, den man passend biegen kann. Um das Reagenzglas daran zu befestigen, umwickelt man es mit dünnem Bindedraht, der an einem Ende zu einem Aufhänger gebogen wird.
Im Gelände füllt man das Reagenzglas randvoll mit Wasser. Es soll eine nach oben gebogene Wasseroberfläche entstehen. In ein Filterpapier wird mit einer Präpariernadel in der Mitte ein Loch gestochen. Dieses Filterpapier wird auf die Wasseroberfläche gelegt. Es saugt sich voll, so dass das Reagenzglas luftblasenfrei gefüllt ist. Jetzt dreht man das Reagenzglas um, so dass seine Öffnung nach unten weist.
Über das feuchte Filterpapier verdunstet das Wasser. Durch das Loch in seiner Mitte wird im Reagenzglas das verdunstete Wasser durch Luft ersetzt.
Man hängt das Evaporimeter an der geeigneten Stelle auf. Nach dem Ende der Messung, die häufig einen halben Tag betragen kann, oder auch länger, markiert man mit einem wasserfesten Stift die Höhe des Wasserstandes im Reagenzglas. Danach leert man es und stellt durch Pipettieren fest, wie viel Wasser in der Mess-Zeit verdunstet war.
Bei Langzeitvergleichen muss man an mehreren Tagen an verschiedenen Orten messen. Dann legt man einen Referenzpunkt fest, an dem jedes Mal ebenfalls gemessen wird, so dass man auch bei unterschiedlichem Wetter vergleichbare Werte erhält.
1.5 Biologische Merkmale von Lebewesen
Wenn man eine Bestimmungs-App benutzt, wird man zu weiteren Informationen zu Wikipedia weitergeleitet. Das kann nützlich sein. Wenn man den Artnamen durch die App erfahren hat, kann man nach weiteren von der ersten unabhängigen Informationen suchen. Erst dann sollte man den Informationen trauen.
Zu den einheimischen Pflanzen gibt es Informationen auf der Website von FloraWeb: https://www.floraweb.de/
Aus der App Flora incognita kann man zu der erkannten Art direkt zu FloraWeb gelangen.
| Artsteckbrief: Startseite | Steckbriefseiten | |
| Sie haben gesucht nach:
Matricaria discoidea DC., Strahlenlose Kamille |
► Startseite
► Bilder & Bestimmung ► Nomenklatur & Taxonomie ► Gefährdung & Schutz ► Verbreitung & Areal ► Lebensraum & Ökologie ► Biologische Merkmale ► Nutzung ► Schmetterlinge |
|
| Informationen dazu aus FloraWeb:
Wissenschaftlicher Name: Matricaria discoidea DC. |
||
Beispiel:
Auf der Startseite der strahlenlosen Kamille, einer Trittpflanze, findet man wie bei allen Arten rechts Verknüpfungen zu einzelnen Steckbriefseiten. Unter „Lebensraum und Ökologie“ sowie „Biologische Merkmale“ werden für das Praktikum wichtige Eigenschaften der Art beschrieben.
Unter „Lebensraum und Ökologie“ findet man zum Beispiel die Zeigerwerte.
Unter „Biologische Merkmale“ findet man viele Angaben zur Fortpflanzung und zu Verbreitungsmechanismen sowie Blattanatomie und Lebensformtyp und weitere.
Daraus kann man besondere Anteile der Ökologischen Nische einer Art ableiten.
Die Kamille hat Zeigerwerte unter anderem für Licht, Temperatur, Reaktion (Säuregrad), Bodenfeuchte und Stickstoffgehalt. Damit sind Standorte mit dieser Kombination an Eigenschaften beschrieben, an denen die Pflanze vorkommt. Sie gehört zu den Ruderalstrategen: Das sind meist einjährige, krautige Pflanzen, die sich u. a. durch kurze Lebensdauer und eine hohe Samenproduktion auszeichnen und dadurch Pionierstandorte besiedeln können.
Sie ist ein Therophyt, eine einjährige Pflanze, die sich durch Samen verbreitet.
Dies geschieht durch Wind oder durch den Verdauungstrakt von Tieren oder durch Kletten und Kleben an Tieren.
Ihre Blattanatomie ist skleromorph, also versteift mit dicklicher Epidermis und Cuticula, aber auch mit Einrichtungen zur Förderung der Wassernachlieferung bei guter Wasserversorgung.
Die möglichen Standorte und biologischen Merkmale kennzeichnen eine Art, so dass man sich gut vorstellen kann, wo und wie sie überlebt. Man erhält einen Ausschnitt aus ihrer ökologischen Nische.
Wenn man für alle Arten, die man an einem Standort findet, die entsprechenden Daten zusammenstellt, kann man ableiten, worin sich die ökologischen Nischen der Arten unterscheiden, sodass diese trotz vieler ähnlicher Ansprüche an einen Standort nebeneinander existieren können.
Die Zeigerwerte bedeuten Folgendes. Beachtet werden muss, dass Zeigerwerte keinesfalls “Ansprüche” jeweiliger Pflanzenarten an die Umweltfaktoren widerspiegeln.
| Faktoren | |||||
| Licht L |
Temperatur T | Feuchte F |
Bodenreaktion R |
Nährsalz = Mineralstoffe N |
|
| 1 = sehr geringer Anspruch | tiefschattig | kalt | sehr trocken | stark sauer | sehr nährsalzarm |
| 3 = geringer Anspruch | schattig | kühl | mäßig trocken | sauer | nährsalzarm |
| 5 = mittlerer Anspruch | halbschattig | mäßig warm | frisch | mäßig sauer | mäßig nährsalzreich |
| 7 = hoher Anspruch | besonnt | warm | feucht | neutral | nährsalzreich |
| 9 = sehr hoher Anspruch | voll besonnt | extrem warm | nass | basisch | sehr nährsalzreich |
| die geraden Zahlenwerte 2, 4, 6 und 8 sind jeweils Zwischenstufen x = indifferent (mit sehr breiter ökologischer Amplitude oder ohne besonderen Anspruch) |
|||||
Ein Netzdiagramm, das sich lediglich auf Zeigerwerte bezieht, sieht für zwei Ruderalpflanzen folgendermaßen aus. Man fertigt es zum Beispiel mit einem Tabellenkalkulationsprogramm an.
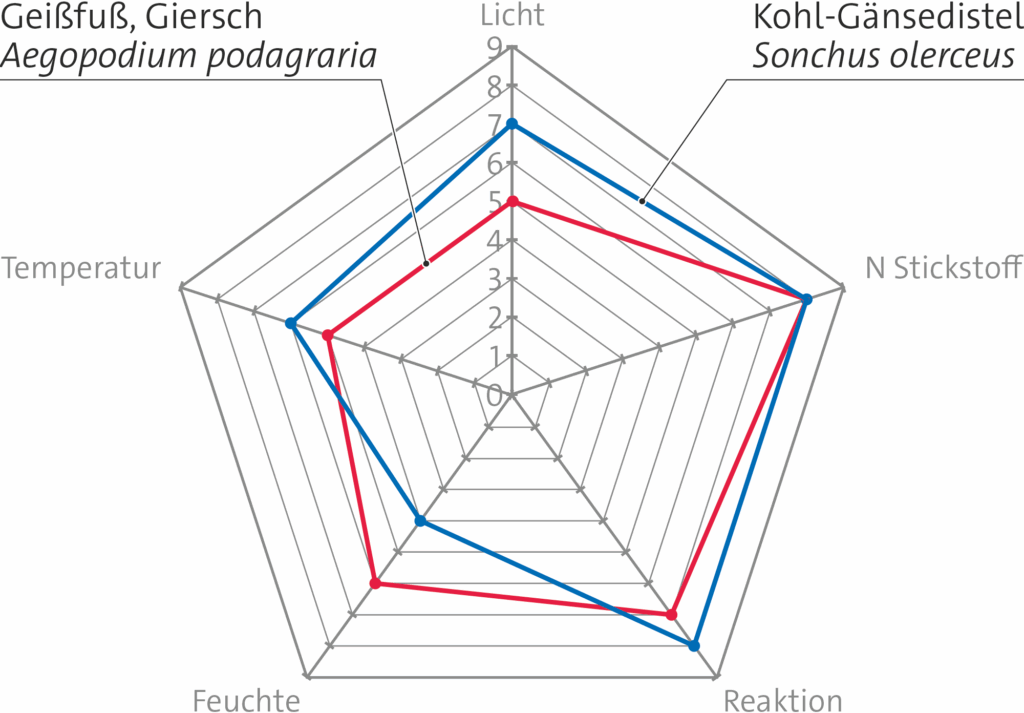
2 Thema Pflaster

Impulse zu möglichen Untersuchungen:
- Die Zeit vor den Sommerferien ist die günstigste. Dann sind die meisten Pflanzen gut entwickelt.
- Die Fugenvegetation ändert sich in Abhängigkeit von Trittbelastung und Reinigungsarbeiten, teilweise in ihrer Zusammensetzung aber auch durch Modifikationen der Pflanzenkörper.
- Die Vegetation der verschiedenen Bereiche und ihre jeweiligen Zeigerwerte siehe 1.5 können auf ihre Korrelation mit den gemessenen Werten zu Boden- und Luftfeuchte, Evaporation, Lichtstärke und ggf. Nitratgehalt des Bodens, siehe 1.2, untersucht werden. Hier sollten die Bereiche auf, zwischen und unter den Pflastersteinen unterschieden werden. Auch Indizien sollten beachtet werden, wie zum Beispiel Hundekot für Nährstoffanreicherung.
- Die Versickerungsgeschwindigkeit von Wasser sollte im Vergleich zu einem Beet oder einem Rasen gemessen werden.
- Die biologischen Merkmale der Pflanzenarten lassen Rückschlüsse über die Möglichkeiten oder Gründe ihrer Anwesenheit im untersuchten Lebensraum zu.
- Bei den vorgefundenen Tierarten muss man die biologischen Merkmale eigenständig recherchieren.
- Weshalb gehört ein künstlicher Lebensraum, wie das Pflaster, zur ökologischen Nische der hier lebenden Arten?
- Bei den Tieren lassen sich in Auswahlversuchen zu Licht, Temperatur und Feuchtigkeit Präferenzen ermitteln. Zweifaktoruntersuchungen zu Licht und Feuchtigkeit sind bei Kellerasseln aussagekräftig und illustrieren das Wirkungsgefüge von Umweltfaktoren.
- Pflanzenarten, die in Pflasterfugen häufig anzutreffen sind: Löwenzahn, Breitwegerich, Niederliegendes Mastkraut, Silber-Birnmoos, Einjähriges Rispengras, Vogelknöterich, Strahllose Kamille, Mäusegerste, Taube Trespe, Große Brennnessel, Kanadisches Berufkraut, Märzveilchen. Dass weitere Arten vorkommen, kann nicht ausgeschlossen werden.
3 Thema Mauer
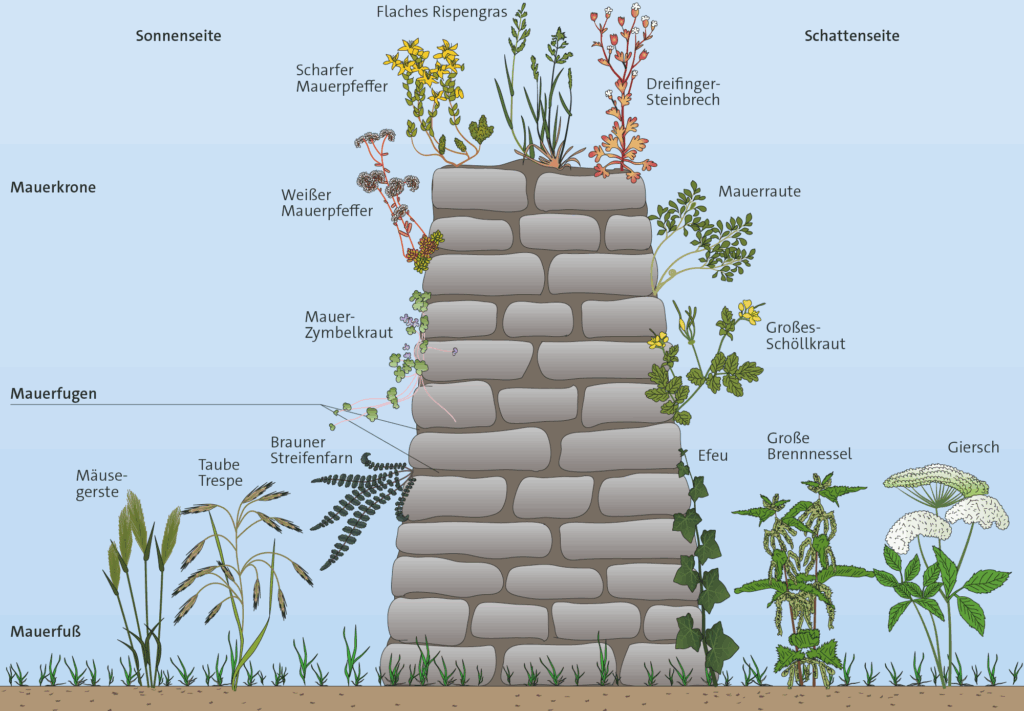
Über die Zeigerwerte von Mauerpflanzen kann man Informationen über den Standort erlangen.
In einer Mauer kommen Pflanzenarten vor, die man verschiedenen Pflanzengesellschaften zuordnet. Nährsalzliebend bedeutet dabei, dass diese Pflanzen an Standorten vorkommen, an denen hohe Mineralstoffmengen verfügbar sind. Wichtig sind hierbei meistens stickstoffhaltige Mineralsalze. Der Begriff „ruderal“ kommt von lateinisch ruderis=„Schutt“.
Eine Ruderalgesellschaft ist eine Gesellschaft von Pflanzen, die sich bevorzugt auf Schuttplätzen, also von Menschen geschaffenen Plätzen, ansiedelt. In der Nähe von Mauern finden diese Pflanzen ebenfalls ihnen passende Bedingungen vor.
Es folgt eine Auswahl von Arten aus den Pflanzengesellschaften an einer Mauer. Es können immer weitere Arten vorkommen.
Die Liste soll helfen, nach den passenden Arten zu suchen, wenn man selbst eine Mauer untersucht. Die Erklärung zu den Werten steht oben:
| Arten der Mauerkronengesellschaften | Licht L |
Temperatur T | Feuchte F |
Bodenreaktion R |
Nährsalz = Mineralstoffe N |
| Weißer Mauerpfeffer | 9 | X | 2 | X | 1 |
| Silberfingerkraut | 9 | 6 | 2 | 3 | 1 |
| Plattes Rispengras | 9 | X | 3 | 9 | 3 |
| Kelch-Steinkraut | 9 | 6 | 3 | 8 | 1 |
| Dreifinger-Steinbrech | 8 | 6 | 2 | 7 | 1 |
| Scharfer Mauerpfeffer | 8 | 6 | 2 | X | 1 |
| Frühlings-Hungerblümchen | 8 | 6 | 3 | X | 2 |
| Kleines Habichtskraut | 7 | X | 4 | X | 2 |
| Mittelwerte | 8,38 | 6,00 | 2,63 | 6,75 | 1,50 |
| Arten der Mauerfugengesellschaft | Licht L |
Temperatur T | Feuchte F |
Bodenreaktion R |
Nährsalz = Mineralstoffe N |
| Mauerraute | 8 | X | 3 | 8 | 2 |
| Wilder Goldlack | 8 | 8 | 5 | 9 | 6 |
| Nordischer Streifenfarn | 8 | X | 3 | 2 | 2 |
| Mauer-Zimbelkraut | 7 | 7 | 6 | 8 | 5 |
| Brauner Streifenfarn | 5 | X | 5 | X | 3 |
| Gewöhnlicher Tüpfelfarn | 5 | 5 | 4 | 2 | 2 |
| Gewöhnliche Hirschzunge | 4 | 5 | 5 | 8 | 4 |
| Mittelwerte | 6,43 | 6,25 | 4,43 | 6,17 | 3,43 |
| Arten der wärmeliebenden Ruderalgesellschaften | Licht L |
Temperatur T | Feuchte F |
Bodenreaktion R |
Nährsalz = Mineralstoffe N |
| Stachel-Lattich | 9 | 7 | 4 | X | 4 |
| Mäusegerste | 8 | 7 | 4 | 7 | 5 |
| Feinblättriger Doppelsame | 8 | 7 | 3 | X | 6 |
| Dach-Pippau | 8 | 6 | 4 | X | 6 |
| Kanadisches Berufskraut | 8 | 6 | 4 | X | 5 |
| Taube Trespe | 7 | 6 | 4 | X | 5 |
| Mittelwerte | 8,00 | 6,50 | 3,83 | 7,00 | 5,17 |
| Arten der nährsalzliebenden Ruderalgesellschaften | Licht L |
Temperatur T | Feuchte F |
Bodenreaktion R |
Nährsalz = Mineralstoffe N |
| Weiße Taubnessel | 7 | X | 5 | X | 9 |
| Geißfuß, Giersch | 5 | 5 | 6 | 7 | 8 |
| Großes Schöllkraut | 6 | 6 | 5 | X | 8 |
| Große Brennnessel | X | X | 6 | 7 | 8 |
| Vogelmiere | 6 | X | X | 7 | 8 |
| Stinkender Storchschnabel | 5 | X | X | X | 7 |
| Gundermann, Gundelrebe | 6 | 6 | 6 | X | 7 |
| Mauerlattich | 4 | 6 | 5 | X | 6 |
| Mittelwerte | 5,25 | 6,00 | 5,50 | 7,00 | 7,00 |
| Arten der Waldgesellschaften | Licht L |
Temperatur T | Feuchte F |
Bodenreaktion R |
Nährsalz = Mineralstoffe N |
| Gewöhnlicher Wurmfarn | 3 | X | 5 | 5 | 6 |
| Frauenfarn | 3 | X | 7 | X | 8 |
| Efeu | 4 | 5 | 5 | X | X |
| Wald-Habichtskraut | 4 | X | 5 | 4 | 4 |
| Hain-Rispengras | 5 | X | 5 | 5 | 4 |
| Mittelwerte | 3,80 | 5,00 | 5,40 | 4,67 | 5,50 |
Bei der Mittelwertbildung werden lediglich die Pflanzen berücksichtigt, die für den jeweiligen Faktor einen Zeigerwert haben. Daher können in einer Pflanzengesellschaft für jeden Faktor unterschiedlich viele Pflanzen zur Mittelwertbildung herangezogen werden. Solche Mittelwerte sind sehr vorsichtig zu interpretieren. Die Zeigerwerte sind keine skalaren Größen. Daher ist die Mittelwertbildung lediglich ein grober Hinweis auf Unterschiede in den Standortbedingungen.
Moospolster auf der Mauerkrone:
- Temperatur im Inneren des Polsters und auf dem Stein und in der Luft messen, ebenso Luftfeuchte. Dazu Moospolster mit Rasierklinge öffnen.
- Austrocknen von Moosen und Wiedervernässen beobachten.
- Tiere aus Moospolster vertreiben, bestimmen und Lebensansprüche feststellen (Dauerstadien, Überdauerungsstrategie, Überdauerungsvermögen, Ökologische Nische).
- Abiotische Faktoren messen, insbesondere die Evaporation und die Lichtstärke, die Vegetation der verschiedenen Bereiche und ihre jeweiligen Zeigerwerte in Relation zu den gemessenen Werten setzen.
Tiere an und in der Mauer:
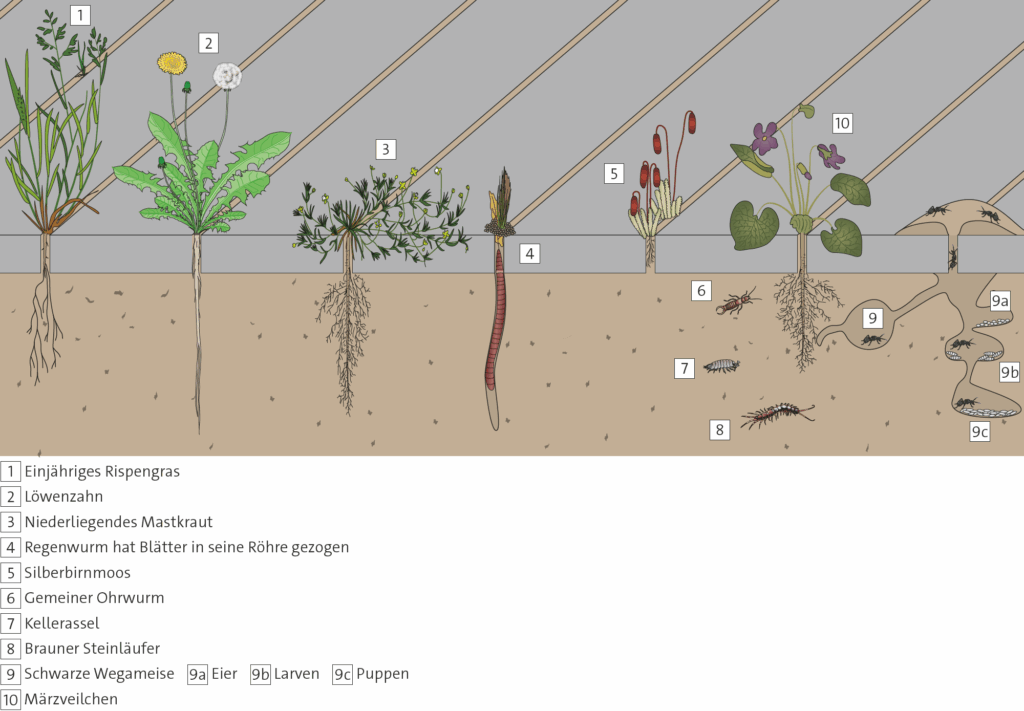
- Informieren Sie sich über die Lebensweisen der in dem Schema zur ökologischen Sonderung dargestellten Spinnentaxa, siehe 1.1.2.
- Vergleichen Sie dabei Habitat und Ernährungsweise sowie Beutespektrum.
- Erklären Sie daran den Begriff Ökologische Nische.
4 Thema Trittflächen
Trittpflanzen kommen im Umfeld der meisten Schulen vor. Sie wachsen auf Feldwegen und Sportplätzen oder auch auf hartgetrampeltem Boden in unmittelbarer Straßennähe. Der Trittfaktor wirkt sich am stärksten aus, wenn der Boden lehmig ist. Nur wenige Pflanzenarten können auf den harten Böden leben und überleben.
In ganz Mittel- und Westeuropa findet man an solchen Stellen nur einige wenige Arten. Immer wachsen dort Strahlenlose Kamille, Vogelknöterich, Einjähriges Rispengras, Breitwegerich, Englisches Raygras (Weidelgras), Gemeiner Löwenzahn und Weißklee.
Niederliegendes Mastkraut, Einjähriges Rispengras, Silber-Birnmoos (= Silbermoos) und Haar-Birnmoos wachsen vor allem zwischen betretenen Pflastersteinen und auf Aschenbahnen. Etwa 46 typische Trittpflanzenarten gibt es. Außer den genannten Arten sind die Zarte Binse, die Gemeine Quecke, das Hirtentäschelkraut, das Niederliegende Mastkraut häufig.
Einige Zeigerwerte von Trittpflanzen. Die Erklärung zu den Werten steht oben:
| Licht L |
Feuchte F |
Bodenreaktion R |
Nährsalz = Mineralstoffe N |
|
| Strahllose Kamille | 8 | 5 | 7 | 8 |
| Vogelknöterich | 7 | X | X | X |
| Einjähriges Rispengras | 7 | 6 | X | 8 |
| Breitwegerich | 8 | 5 | X | 6 |
| Englisches Raygras | 8 | 5 | X | 7 |
| Gemeiner Löwenzahn | 7 | 5 | X | 7 |
| Weißklee | 8 | X | X | 7 |
| Niederliegendes Mastkraut | 6 | 6 | 7 | 6 |
| Zarte Binse | 6 | 6 | 5 | 5 |
| Gemeine Quecke | 6 | 5w | X | 8 |
w = Wechselfeuchtezeiger
| Eigenschaften von Trittpflanzen
Die hier aufgeführten Eigenschaften sind generell charakteristisch für die Trittpflanzen. Es ist jedoch nicht jede Eigenschaft bei allen Trittpflanzen ausgeprägt. |
|
| Zur Erhaltung der vegetativen Organe | Zur Sicherstellung der Vermehrung |
| Kleinwüchsigkeit | Starke vegetative Vermehrung und Ausbreitung |
| Starke Verzweigung, bodennahe Lage der Stängel und Blätter (Rosettenwuchs) | Geringer Abstand der Blüten von der Wurzel |
| Kleine Blätter | Kleine Blüten |
| Festigkeit der Gewebe, insbesondere der Leitbündelscheiden | Selbstbestäubung (Autogamie) |
| Biegungsfähigkeit bewirkende, also möglichst zentrale Anordnung der mechanischen Elemente | Kurze Entwicklungsdauer bis zur Samenreife
Kleine, harte, auflaufkräftige Samen |
| Überwinterung als Hemikryptophyten oder Therophyten | Große Samenzahl der einzelnen Pflanzen |
| Lange Lebensdauer der einzelnen Pflanzen | Verbreitung durch den Tritt der Tiere (bei ca. 60 % der Arten) |
| Große Stoffspeicherung und gutes Regenerationsvermögen | Häufigkeit in benachbarten Lebensräumen |
Weitere Eigenschaften: Breitwegerich (Großer Wegerich) und Vogelknöterich sind ausgesprochene Nasskeimer. Der auf verdichtetem Lehmboden eintretende Wasserstau begünstigt sie also. Gräser wie das Einjährige Rispengras keimen ebenfalls am besten bei anhaltender Feuchtigkeit. Der Weißklee braucht eine genügend feuchte Bodenfläche, damit sich seine oberirdischen Ausläufer bewurzeln können.
Hinweise:
- Artsteckbrief Breitwegerich aus FloraWeb zusammenstellen. Auf die vorgestellten Eigenschaften achten. Mögliche Angepasstheiten an Standortfaktoren herausstellen. Dazu Messung geeigneter Standortfaktoren, siehe Kapitel 4.
- Verteilung von Breitwegerich-Individuen auf einem Rasen in einem Park. Verbreitungsmechanismus und Blattanatomie sind zur Erklärung der Verteilung von Bedeutung.
siehe Kapitel 3. - Größe der Blattflächen bei verschiedenen Arten an verschiedenen Stellen (Lichtstärke, Temperaturen in verschiedenen Höhen und unter Blattrosetten, sowie in 5 cm Bodentiefe, Evaporation, Wasserversickerung messen) mit abiotischen Faktoren korrelieren und auf kausale Zusammenhänge schließen, falls möglich. Hierbei Wasserversorgung der Pflanze und Lichtgenuss in Betracht ziehen.
5 Thema Brachen
5.1 Lebensraum Brache
Brachen werden spontan besiedelt oder entwickeln sich ohne menschliche Einflüsse weiter. Sie sind daher in der Zusammensetzung nicht einheitlich. Wegen der nicht durch Menschen beeinflussten Konkurrenz repräsentieren sie nach einiger Zeit den Einfluss der Standortfaktoren auf die Artenzusammensetzung. Diese wird allerdings zusätzlich durch die aktuelle Pflanzengemeinschaft und die Konkurrenz der Arten untereinander mit bestimmt.
Daher ist es zur Bewertung des Standorts sinnvoll, die Arten zu erfassen und mithilfe ihrer Zeigerwerte den Standort zu bewerten. Die Biologischen Merkmale der Arten tragen zur Erklärung ihrer Existenz am Standort bei. Die Dynamik an solchen Standorten ist groß. Daher sind Langzeitprotokolle durch Schülerinnen und Schüler verschiedener Jahrgangsstufen sinnvoll.
Brachen sind als besonders wertvoll zu betrachten, da natürliche und dynamische Abläufe unbeeinflusst stattfinden, und sie bieten Lebens- und Rückzugsraum für ein Artenspektrum, das sich auf intensiven Produktionsflächen kaum entwickeln kann.
5.1.1 Methodische Erschließung
Da Brachen häufig keine einheitlichen Flächen sind, ist es sinnvoll, einen Transekt zu untersuchen.
Ausgehend von einem Gradienten zu einem abiotischen Faktor, z.B. dem Licht, steckt man einen Transekt ab. Bei der Auswertung kann man dann den Einfluss dieses Faktors den Einflüssen anderer Faktoren gegenüberstellen. So wird deutlich, dass verschiedene Faktoren auf die Lebewesen wirken. Mithilfe der Zeigerwerte der Pflanzen kann man diese Auswertung auch als Schülerin oder Schüler leisten.
Auch die Wasserdurchlässigkeit des Bodens, Bodenfeuchte, Lichtverhältnisse, pH-Wert des Bodens, Nitratgehalt des Bodens, Deckungsgrad (5.1.4) der Vegetation und Tritt können schon nach visuellem Eindruck und groben Kenntnissen zu den Zeigerwerten bestimmter Arten Anlass bieten, genauer nachzumessen und einen Transekt abzustecken.
Eine praktikable Transektbreite ist ein Meter. Dadurch erhält man in angemessenen Abständen Untersuchungsflächen mit dem Flächeninhalt von einem Quadratmeter, 1 m x 1 m.
5.1.2 Vorbereitungen für die Freilandarbeit
Die Probeflächen sollten durch eine Vorerkundung durch die Lehrkraft ausgewählt werden.
Im Hinblick auf die Auswertung ist es sinnvoll, dass nicht zu viele Arten vorkommen, also
- innerhalb der ca. 1 m2 Fläche mindestens eine Pflanzenart (max. zwei Arten) dominant ist.
Bei der Flächenauswahl ist zu gewährleisten, dass dort Vegetationsbestände vorherrschen, deren Pflanzenarten
- besondere Zeigereigenschaften besitzen (z.B. Mäusegerste),
- einen Neophyten repräsentieren (z.B. Goldruten-Arten),
- eine Trittpflanzenart aufweisen (z.B. Breitblättriger Wegerich),
- Pioniergehölze und/oder typische Strauchartige beinhalten.
5.1.2.1 Beispiel einer Auswertung
Die Erklärung zu den Werten steht oben.
| Probefläche | ||||||||
| Art | 1 | 2 | 3 | Zeigerwerte | ||||
| Deckungsgrad | Licht L |
Temperatur T | Feuchte F |
Bodenreaktion R |
Nährsalz = Mineralstoffe N |
|||
| Echte Brombeere (Rubus fruticosus) | 2 | 5 | – | 7 | 4 | 5 | 5 | 5 |
| Glatthafer (Arrhenatherum elatius) | 3 | – | 3 | 8 | 5 | 5 | 7 | 7 |
| Gemeiner Rainfarn (Tanacetum vulgare) | 4 | – | r | 8 | 6 | 5 | 8 | 5 |
| Rotes Straußgras (Agrostis capillaris) | + | – | – | 7 | x | x | 4 | 4 |
| Wolliges Honiggras (Holcus lanatus) | 1 | – | – | 7 | 6 | 6 | x | 4 |
| Sand-Straußgras (Agrostis vinealis) | 2 | – | – | 9 | 7 | 2 | 2 | 1 |
| Große Brennnessel (Urtica dioica) | – | 2 | – | x | x | 6 | 7 | 8 |
| Kanadische Goldrute (Solidago canadensis) | 1 | r | – | 8 | 6 | x | x | 6 |
| Wiesenkerbel (Anthriscus sylvestris) | – | 1 | – | 7 | x | 5 | x | 8 |
| Klebkraut (Galium aparine) | – | r | – | 7 | 6 | x | 6 | 8 |
| Sal-Weide (Salix caprea) | – | – | 5 | 7 | x | 6 | 7 | 7 |
| Gemüsespargel (Asparagus officinalis) | – | – | 1 | 6 | 6 | 3 | x | 4 |
| Wiesen-Knäuelgras (Dactylis glomerata) | – | – | + | 7 | x | 5 | x | 6 |
| Sumpf-Rispengras (Poa palustris) | – | – | + | 7 | 5 | 9 | 8 | 7 |
| Anteil (%) | ||||||||
| Lebensform Hemikryptophyten | 100 | 62,5 | 66,7 | |||||
| Lebensform Therophyten (Störungszeiger) | 0 | 25 | 0 | |||||
| Trittpflanzen | 0 | 0 | 0 | |||||
| Neophyten | 0 | 25 | 0 | |||||
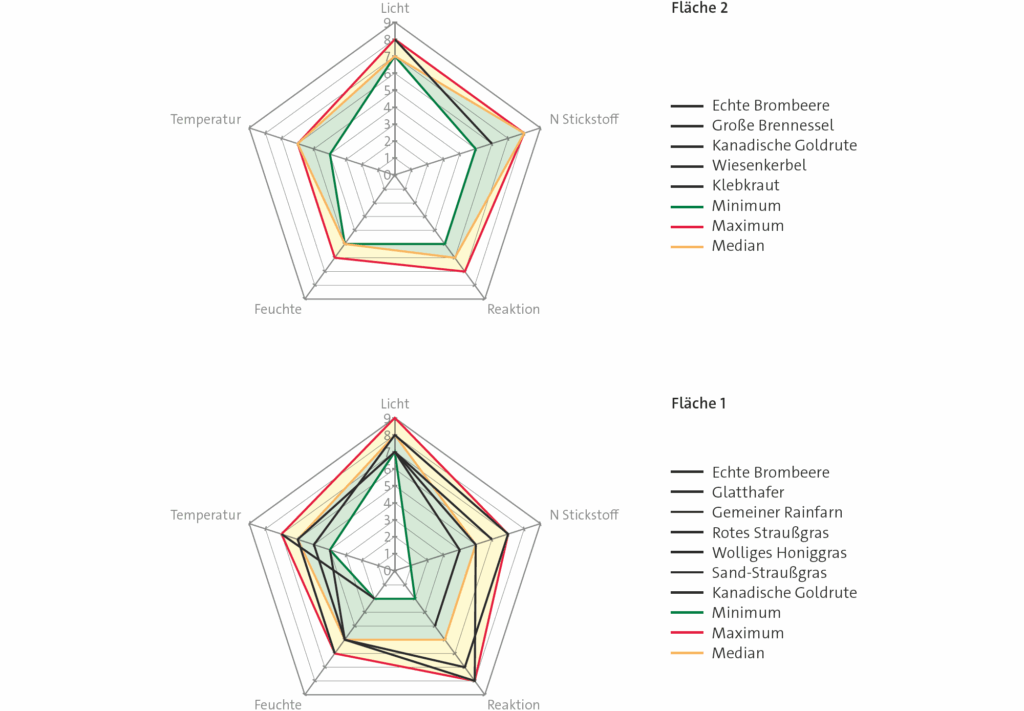
Die beiden Flächen liegen in hell beleuchteten Bereichen. Bei Fläche 1 ist die Streubreite in allen Werten größer als bei Fläche 2. Das kann mehrere Ursachen haben. Zunächst kann der Boden in Fläche 1 sehr kleinräumig unterschiedliche Werte der Feuchte, der Bodenreaktion und des Nährstoffgehalts haben. Bei einer Brache weiß man nicht immer, was dort vorher war oder ob etwas abgelagert worden ist. Andererseits kann aber auch der Ablauf der Besiedlung der Fläche eine Rolle spielen:
Wer zuerst eine Brache besiedelt, steht erst einmal dort. Die meisten Pflanzen haben eine viel größere physiologische Potenz (= Toleranz) als ökologische Potenz (= Existenz). Die Zeigerwerte sind nur dann aussagekräftig, wenn die standorttypische Konkurrenz lange genug gewirkt hat.
Mithilfe von Messwerten zu den abiotischen Faktoren könnte man untersuchen, welche der genannten Erklärungsmöglichkeiten wahrscheinlich ist. Des Weiteren kann man sich die Verbreitungstypen der Arten ansehen. Diese können erklären, ob eine zufällige Besiedlung durch die Arten wahrscheinlich ist. Die Lebensformtypen geben Auskunft, wie gut sich eine Art an einer Stelle halten kann. Therophyten benötigen offene Bodenflächen, auf denen sie sich im nächsten Jahr neu entwickeln können. Hemikryptophyten behalten im Winter eine Blattrosette und besetzen damit ganzjährig eine Stelle. Daher wird die auf Fläche 1 sichtbare Vielfalt sich nicht schnell verringern. Höher wachsende Arten, die sich eventuell noch ansiedeln, könnten auf lange Sicht zu einer Änderung führen. Auf Fläche 2 ist das Klebkraut in der Lage, sich zwischen dem Brombeergestrüpp jährlich neu zu etablieren. Eine mögliche Weise, in der das Klebkraut sich behauptet, besteht darin, dass es in der Vegetationszeit andere Pflanzen überwuchert und sich so auch Platz verschafft. Einige grüne Blätter können überwintern, so dass die Pflanze im Frühjahr gute Startbedingungen hat. Sie wird als Übergangstyp zwischen dem Konkurrenztyp und dem Ruderaltyp beschrieben. Sie ist also nicht allein auf gestörte Flächen angewiesen.
In der Fläche 1 und 2 findet man die Kanadische Goldrute, einen Neophyt. In Fläche 1 ist sie etwas häufiger vertreten als in Fläche 2. Sie bildet unterirdisch Ausläufer und kann damit andere Arten verdrängen. Da die Goldrute eine invasive Art ist, wird es sich lohnen, die Flächen in den Folgejahren weiter zu beobachten, so dass man eventuell folgern kann, gegen welche Arten sie sich auf Dauer durchsetzt.
Der gewählte Transekt mit 3 Probeflächen war nicht länger als 15 Meter. Daher zeigen die Werte, dass schon auf solch kurzer Strecke deutliche Änderungen abiotischer Faktoren möglich sind. Fläche 1 scheint besonders nährstoffreich zu sein, Fläche 2 mit teilweise hoher Reaktionszahl, also basenreich. Es müsste teilweise einer hoher Kalkgehalt zu messen sein, möglicherweise auch von Bauschutt.
5.1.3 Geräte und Materialien für geplante Geländearbeiten
Zur Artenerfassung in 1 m2 großen Probeflächen benötigt man pro Gruppe:
- Holz- oder Leichtmetallrahmen (1 m2),
- Ersatzweise: Wäscheleine mit Knoten nach jeweils 1 m Länge und Holzpflöcke oder Metallstäbe, die – in den Boden eingebracht – zur Befestigung der Leine dienen.
- Zollstock, Maßband, Schreibzeug, Bestimmungsapps.
5.1.4 Übersicht der Deckungsgrade
| Symbol | Individuenzahl | Deckung |
| r | selten, ein Exemplar | deutlich unter 1 % |
| + | wenige (2 bis 5) Exemplare | bis 1 % |
| 1 | viele (6 bis 50) Exemplare | bis 5 % |
| 2 | sehr viele (über 50) Exemplare | bis 5 % |
| (oder beliebig) | 5 bis 25 % | |
| 3 | (beliebig) | 26 bis 50 % |
| 4 | (beliebig) | 51 bis 75 % |
| 5 | (beliebig) | 76 bis 100 % |
Hinweis zur Bestimmung des Deckungsgrades
Die Bestimmung der Deckungsgrade sollte mit den Schülern gemeinsam an 1 – 2 Beispielflächen im Gelände geübt und erklärt werden. Als Hilfe hat sich bewährt, dass man gedanklich alle Individuen einer Art in eine Ecke des Quadrats „verschiebt“.
5.1.5 Erfassung der Standortverhältnisse
Es sollten pH-Wert, Bodenfeuchte und Lichtverhältnisse am Standort erfasst werden.
Benötigte Geräte:
- pH-Meter oder pH-Teststäbchen
- Luxmeter
- Handschaufel.
5.1.6 Datenbearbeitung
Es ist sinnvoll, folgende Werte zu berechnen:
- der prozentuale Anteil der Lebensformtypen für jede Untersuchungsfläche
- der prozentuale Anteil von Trittpflanzen für jede Untersuchungsfläche
- der prozentuale Anteil von Neophyten für jede Untersuchungsfläche
5.1.7 Artenlisten
| Geeignete Untersuchungspflanzen | |
| Gemeiner Beifuß – Artemisia vulgaris | Weißer Steinklee – Melilotus albus |
| Dominanzbestände ausbildend, oft auch mit dem Rainfarn vergesellschaftet. | In Dominanzbeständen auftretend oder mit
dem Gelben Steinklee, die zweijährige Steinklee-Gesellschaft ausbildend. |
| Gemeiner Rainfarn – Tanacetum vulgare | Weißer Gänsefuß – Chenopodium album |
| Kenn-Art der Rainfarn-Beifuß-Gesellschaft | Pionier auf offenen Standorten, in Dominanzbeständen, oder mit anderen einjährigen Arten. |
| Acker-Kratzdistel – Cirsium arvense | Kanadisches Berufkraut – Conyza canadensis |
| Oft reine Dominanzbestände ausbildend | Neophyt, Pionierpflanze, kurzlebige Gesellschaft mit z.B. dem Kompass-Lattich, des Öfteren auch als Bestand und dann mit weiteren einjährigen Arten auftretend. |
| Gemeine Brennnessel – Urtica dioica | Mäusegerste – Hordeum murinum |
| Oft Dominanzbestände ausbildend, aber auch in halbschattigen Saumgesellschaften mit Giersch, Wiesenkerbel oder Weißer Zaunwicke. | Lichtpflanze und Wärmezeiger, Kennart der Mäusegersten-Gesellschaft. |
| Giersch – Aegopodium podagraria | Taube Trespe – Bromus sterilis |
| Dominanzbestände ausbildend oder mit der Großen Brennnessel zum halbschattigen Brennnessel-Giersch-Saum vergesellschaftet. | Ersetzt oft die Mäusegersten-Flur und tritt des Öfteren als Dominanzbestand auf. |
| Riesen-Goldrute – Solidago gigantea
Kanadische Goldrute – Solidago canadensis |
Breitblättriger Wegerich – Plantago major |
| Neophyten. Beide Goldruten-Arten meistens getrennt in Dominanzbeständen auftretend; manchmal auch gemeinsam als Goldruten-Gesellschaft, oft in andere Hochstauden-Gesellschaften eindringend z.B. in die Rainfarn-Beifuß-Gesellschaft. | Typische Trittpflanze in mehrjährigen Trittrasen, oft mit Weißklee und Deutschem Weidelgras vergesellschaftet. |
In Wien wurden in den Jahren 1994 und 1995 in Stadtbrachen folgende Arten gefunden:
Baumschicht:
| Acer campestre | Feldahorn |
| Acer negundo | Eschenahorn |
| Acer platanoides | Spitzahorn |
| Acer pseudoplatanus | Bergahorn |
| Aesculus hippocastanum | Rosskastanie |
| Ailanthus altissima | Götterbaum |
| Alnus glutinosa | Schwarzerle |
| Betula pendula | Hängebirke |
| Carpinus betulus | Weißbuche |
| Eleagnus angustifolia | Schmalblättrige Ölweide |
| Fagus sylvatica | Rotbuche |
| Fraxinus excelsior | Esche |
| Juglans regia | Walnuss |
| Larix decidua | Europäische Lärche |
| Malus domestica | Kulturapfel |
| Picea abies | Fichte |
| Pinus nigra | Schwarzkiefer |
| Pinus sylvestris | Waldkiefer |
| Platanus x hispanica | Ahornblättrige Platane |
| Populus-Arten | Pappel-Arten |
| Prunus avium | Vogelkirsche |
| Prunus-Arten | Kirsche, Pflaume, Schlehe etc. |
| Robinia pseudacacia | Robinie |
| Salix-Arten | Weiden-Arten |
| Taxus baccata | Eibe |
| Tilia-Arten | Linden-Arten |
| Ulmus glabra | Bergulme |
| Ulmus minor | Feldulme |
Strauchschicht:
| Berberis vulgaris | Gewöhnliche Berberitze |
| Buddleja davidii | Gewöhnlicher Sommerflieder |
| Clematis vitalba | Gewöhnliche Waldrebe |
| Cornus mas | Kornelkirsche |
| Cornus sanguinea | Blutroter Hartriegel |
| Corylus avellana | Gewöhnliche Hasel |
| Crataegus monogyna | Eingriffeliger Weißdorn |
| Euonymus europaeus | Europäisches Pfaffenhütchen |
| Forsythia intermedia | Hybrid-Forsythie |
| Hedera helix | Gewöhnlicher Efeu |
| Laburnum anagyroides | Gewöhnlicher Goldregen |
| Ligustrum vulgare | Gewöhnlicher Liguster |
| Mahonia aquifolium | Gewöhnliche Mahonie |
| Ribes-Arten | Johannisbeeren |
| Rosa canina agg. | Hundsrose |
| Rubus-Arten | Brombeeren |
| Sambucus nigra | Schwarzer Holunder |
| Sorbus-Arten | Verwandte der Vogelbeere |
| Spiraea-Arten | Spierstrauchverwandte |
| Syringa vulgaris | Gewöhnlicher Flieder |
| Thuja-Arten | Lebensbaumarten |
| Vitis vinifera | Weinrebe |
Kraut-/Grasschicht:
| Achillea millefolium | Gewöhnliche Schafgarbe |
| Amaranthus-Arten | Amarant |
| Anthriscus sylvestris | Wiesen-Kerbel |
| Arctium lappa | Große Klette |
| Arrhenaterum elatior | Glatthafer |
| Artemisia vulgaris | Beifuß |
| Aster-Arten | Aster-Arten |
| Brassica-Arten | Kohl-Verwandte |
| Calamagrostis epigeios | Sand-Reitgras |
| Capsella bursa-pastoris | Hirtentäschelkraut |
| Cardamine-Arten | Schaumkraut-Arten |
| Carduus acanthoides | Weg-Distel |
| Chelidonium majus | Schöllkraut |
| Chenopodium album | Weißer Gänsefuß |
| Cichorium intybus | Gewöhnliche Wegwarte |
| Cirsium-Arten | Distelarten |
| Crepis biennis | Wiesen-Pippau |
| Dactylis glomerata | Gewöhnliches Knaulgras |
| Daucus carota | Gewöhnliche Möhre |
| Erigeron annuus | Feinstrahl-Berufkraut |
| Euphorbia-Arten | Wolfsmilch-Arten |
| Fragaria-Arten | Erdbeerarten |
| Galinsoga ciliata | Zottiges Franzosenkraut |
| Galinsoga parviflora | Kleinblütiges Franzosenkraut |
| Galium-Arten | Labkraut-Arten |
| Geranium-Arten | Storchschnabel-Arten |
| Geum urbanum | Echte Nelkenwurz |
| Glechoma hederacea | Gewöhnlicher Gundermann |
| Hordeum murinum | Mäusegerste |
| Humulus lupulus | Gewöhnlicher Hopfen |
| Lactuca serriola | Kompass-Lattich |
| Lamium maculatum | Gefleckte Taubnessel |
| Lamium purpureum | Purpurrote Taubnessel |
| Leontodon-Arten | Löwenzahn-Arten |
| Lolium perenne | Ausdauernder Lolch |
| Lycium barbarum | Gewöhnlicher Bocksdorn |
| Malva-Arten | Malven-Arten |
| Medicago-Arten | Schneckenklee-Arten |
| Phragmites australis | Gewöhnliches Schilf |
| Plantago-Arten | Wegerich-Arten |
| Poa-Arten | Rispengras-Arten |
| Polygonum aviculare | Echter Vogelknöterich |
| Potentilla-Arten | Fingerkraut-Arten |
| Rumex-Arten | Ampfer-Arten |
| Senecio vulgaris | Gewöhnliches Greiskraut |
| Silene vulgaris | Gewöhnliches Leimkraut |
| Sisymbrium loiselii bei uns eher S. vulgare | Loesels Rauke |
| Solanum nigrum | Schwarzer Nachtschatten |
| Solidago gigantea | Riesen-Goldrute |
| Taraxacum officinale | Wiesen-Kuhblume |
| Trifolium pratense | Rotklee |
| Trifolium repens | Weißklee |
| Urtica dioica | Große Brennnessel |
| Verbascum-Arten | Königskerzen-Arten |
| Veronica-Arten | Ehrenpreis-Arten |
| Viola-Arten | Veilchen-Arten |
Die am häufigsten gefundenen Arten sind die folgenden:
Baumschicht
Ailanthus altissima – Götterbaum, Acer platanoides – Spitzahorn, Populus-Arten – Pappeln, Robinia pseudacacia – Robinie, Fraxinus excelsior -Esche.
Strauchschicht
Rosa canina agg. – Hundsrose, Sambucus nigra – Schwarzer Holunder, Clematis vitalba – Gewöhnliche Waldrebe, Buddleja davidii – Gewöhnlicher Sommerflieder, Rubus– Arten – Brombeer-Arten.
Krautschicht
Artemisia vulgaris – Beifuß, Urtica dioica – Große Brennnessel, Polygonum aviculare – Vogelknöterich, Poa-Arten – Rispengras-Arten, Chenopodium album – Weißer Gänsefuß.
Das Artenspektrum in Wien kann als Artenauswahl genutzt werden, um in der eigenen Stadt in Stadtbrachen nach diesen Arten zu suchen oder an einzelnen anderen Arten zu erkennen, dass in der eigenen Stadt eine mögliche Besonderheit vorliegt, die man untersuchen kann.
5.1.8 Thema Gestörte Flächen ohne größere Trittbelastung
Abgesehen von größeren Brachen gibt es Baumscheiben, die nicht bepflanzt sind, Wegränder, die nicht gepflegt werden oder andere offenen Stellen, die selten begangen werden. Hier kann man die gleichen Untersuchungen machen wie auf der Brache.
Besondere Pflanzenarten dieser Bereiche sind eher kurzlebig. Typische Vertreter sind:
- Weißer Steinklee – Melilotus albus
- Weißer Gänsefuß – Chenopodium album
- Kanadisches Berufkraut – Conyza canadensis
- Mäusegerste – Hordeum murinum
- Taube Trespe – Bromus sterilis
- Breitblättriger Wegerich – Plantago major
6 Addendum Citizen Science
6.1 Beispiel ‚Invasive Arten‘ App ZOWIAC
Im Projekt ZOWIAC (Zoonotische und wildtierökologische Auswirkungen invasiver Carnivoren) wird untersucht, wie sich der Waschbär, der Marderhund und der Mink auf bedrohte einheimische Arten und die jeweiligen Ökosysteme auswirken und mit welchen Parasiten und anderen Krankheiten auslösenden Erregern sie befallen sind.
Mit der ZOWIAC-App kann man Daten über die Verbreitung sowie das weitere Ausbreitungspotenzial von Waschbär und Co. in Deutschland beisteuern: Tierbeobachtungen, Spuren, Kot oder Fraßspuren. Die so gewonnenen Forschungsdaten können für weitere Untersuchungen, wie beispielsweise Wildtier Monitoring, von großem Nutzen sein. Auf der Website des Projekts findet man alles über die Forschung zu den Wildtieren.
6.2 Beispiel Observation international und Observation.org
Eine gemeinnützige Stiftung mit dem Namen Observation international betreibt eine Website: Observation.org. Sie ist eine globale Biodiversitätsplattform für Citizen Science und Monitoring.
Ziel ist die Förderung der Naturforschung und des Naturschutzes durch Sammlung, Verbesserung und Austausch von Biodiversitätsdaten durch das Sammeln von Beobachtungen. Die Beobachtungen werden auf ihre Zuverlässigkeit und Gültigkeit (Richtigkeit) durch sogenannte Validatoren geprüft.
Die Daten von Observation.org werden aktiv zur Verfolgung der Verbreitung von Arten und des Klimawandels, zur Frühwarnung vor invasiven gebietsfremden Arten, zur Überwachung von Krankheitsüberträgern und zur Bürgerbeteiligung genutzt. Daten wurden von 2004 bis 2024 in über 2.000 wissenschaftlichen Publikationen veröffentlicht.
Die offenen Daten findet man auf GBIF (Global Biodiversity Information Facility).
GBIF ist eine zwischenstaatliche Initiative mit dem Ziel, freien Zugang zu Biodiversitätsdaten voranzubringen. Mitglieder des Netzwerks sind sowohl Länder als auch internationale Organisationen. Aufgabe von GBIF ist es, die Veröffentlichung und Nutzung großer Mengen an Biodiversitätsinformationen zu ermöglichen, dadurch Aufwand und Kosten für eventuelle wiederholte Datenaufnahmen zu vermeiden und somit die Wissenschaft voranzubringen. GBIF wurde 2001 infolge einer Empfehlung einer Unterarbeitsgruppe der OECD offiziell eingerichtet.
Eigene Beobachtungen kann man über die Website oder mithilfe der App „ObsMapp“ mitteilen. Man muss allerdings einen Account einrichten, wenn die Daten anderen zur Verfügung gestellt werden sollen.