Hier findest du die Lösungen zu den Check-up-Aufgaben des Kapitels Temperatur und Wärme.
Gegeben:
Länge \(l = 6,3 \, \text{m} \)
Breite \(b = 3,5 \, \text{m} \)
Höhe \(h = 0,4 \, \text{m} \)
Dichte \(\rho\ = 2400 \, \frac{\text{kg}} {\text{m}^3} \)
a) Gesucht:
Volumen \(V \)
Berechnung:
\(V = a \cdot b \cdot c = l \cdot b \cdot h \)
\(V = 6,3 \, \text{m} \cdot 3,5 \, \text{m} \cdot 0,4 \, \text{m} = 8,8 \, \text{m}^3\)
b) Gesucht:
Masse \(m \)
Berechnung:
\(\rho\ = \frac{m}{V} \Rightarrow m = \rho\ \cdot V \)
\(m = 2400 \, \frac{\text{kg}} {\text{m}^3} \cdot 8,8 \, \text{m}^3 = 21120 \, \text{kg}\)
c) Gesucht:
Anzahl der Fahrten \(N \)
Berechnung:
\(N = \frac{m}{m_\text{max}} = \frac{21120 \, \text{kg}}{580 \, \text{kg}} = 36,4 \)
Ergebnis:
Das Fundament hat ein Volumen von \(8,8 \, \text{m}^3 \) und eine Masse von \(21120 \, \text{kg} \). Martin müsste insgesamt 37-mal zum Baumarkt hin- und zurückfahren.
Als Beispiel können unterschiedliche Massen an Wasser genutzt werden, z. B. 10 g, 20 g und 30 g.
Wasser hat eine Dichte von \(\rho\ = 1,0 \, \frac{\text{g}} {\text{cm}^3} \).
10 g Wasser nehmen also ein Volumen von 10 cm³ ein, 20 g entsprechen 20 cm³ und 30 g entsprechen 30 cm³. Das bedeutet, wenn eine der beiden Größen (Masse oder Volumen) steigt, dann wird die andere Größe ebenfalls immer um den gleichen Faktor (hier die Dichte) größer.
Kupferwürfel:
\(\rho\ = \frac{m}{V} = \frac{4,48 \, \text{g}} {0,5 \, \text{cm}^3} = 8,96 \, \frac{\text{g}}{\text{cm}^3} \)
Aluminiumwürfel:
\(\rho\ = \frac{m}{V} = \frac{4,59 \, \text{g}} {1,7 \, \text{cm}^3} = 2,7 \, \frac{\text{g}}{\text{cm}^3} \)
Styroporwürfel:
\(\rho\ = \frac{m}{V} = \frac{0,06 \, \text{g}} {1,0 \, \text{cm}^3} = 0,06 \, \frac{\text{g}}{\text{cm}^3} \)
a) Im Teilchenmodell besteht ein fester Stoff aus Teilchen, die eng beieinander liegen und eine regelmäßige Anordnung haben. Der Zusammenhalt der Teilchen ist stark und sie befinden sich an einem festen Platz. Dadurch hat der Stoff eine feste Form.
Ein flüssiger Stoff besteht im Teilchenmodell aus Teilchen, die weniger geordnet sind als in einem festen Stoff. Der Zusammenhalt der Teilchen ist geringer, sodass sie frei beweglich sind. Dies führt dazu, dass ein flüssiger Stoff die Form des Behälters annimmt, in dem er sich befindet.
b) Ein Luftballon lässt sich problemlos zusammenpressen, da die Teilchen in Gasen einen großen Abstand zueinander und keinen Zusammenhalt haben. Sie lassen sich sehr stark zusammenpressen und haben deshalb auch keine feste Form. Sie nehmen die Form des Gefäßes an, in dem sie sich befinden.
c) Im Teilchenmodell ist die Dichte eines Stoffes eine Größe, die von der Anzahl der Teilchen des Stoffes pro Volumeneinheit und der Masse der Teilchen abhängig ist.
a) Nach dem Teilchenmodell besteht Zuckerwürfel aus Teilchen. Wird der Zucker in den Tee gegeben, löst sich der feste Zusammenhalt der Teilchen auf. Die Teilchen verteilen sich durch die Eigenbewegung in der ganzen Tasse (Diffusion), bis sie gleichmäßig verteilt sind. Dadurch schmeckt der ganze Tee süß.
b) Wasser ist eine Flüssigkeit. Es besteht aus Teilchen, die nur einen kleinen Zusammenhalt haben und gegeneinander verschiebbar sind. Daher fließt die Flüssigkeit leicht und lässt sich in beliebige Formen aufteilen.
Ein Eiswürfel hingegen ist ein fester Körper, in dem die Teilchen einen festen Zusammenhalt haben und sich nur minimal bewegen können. Deshalb kann man einen Eiswürfel nicht einfach teilen, sondern muss ihn erst mit Kraft zerbrechen.
a) Beispiele:
- Die Lufttemperatur empfindet jede Person etwas anders, weshalb wir uns unterschiedlich dick anziehen. Bei der gleichen Temperatur ziehen manche lieber lange und dicke, andere wiederum kurze und dünne Kleidung an.
- Fasst man nacheinander Gegenstände aus Holz, Metall und Glas an, die sich im gleichen Raum befinden, fühlen sie sich unterschiedlich warm an.
- Wenn man bei niedrigen Außentemperaturen von draußen in die Wohnung kommt, fühlt es sich eher warm an. Wenn man bei hohen Außentemperaturen in die gleiche Wohnung kommt, fühlt es sich eher kühl an.
b) Wenn wir selbst wissen wollen, ob das Wasser im Schwimmbecken warm oder kalt ist, können wir den Fuß hineinhalten. Würden das mehrere Personen gleichzeitig machen, würden alle aufgrund des unterschiedlichen Temperaturempfindens zu anderen Einschätzungen kommen. Wir sind nicht in der Lage, Temperaturen korrekt festzustellen. Wenn man exakt wissen will, wie warm oder kalt das Wasser ist, müssen wir die Temperatur unabhängig von unserem Empfinden messen. Deshalb nutzen wir zur Messung von Temperaturen Thermometer.
- Nr. 1 Gefrierthermometer: Die meisten Gefrierschränke kühlen bis auf ungefähr –20 °C herunter. Da auch eine Messung oberhalb der Raumtemperatur nicht sinnvoll ist, passen Messbereich und Genauigkeit hier gut zum Zweck des Thermometers.
- Nr. 2 Fieberthermometer: Innerhalb des Messbereichs ist eine genaue Messung auf 0,1 °C wichtig. Liegt die Temperatur außerhalb des Messbereichs, besteht große Gefahr für die Gesundheit.
- Nr. 3 Außenthermometer: Zum Beispiel an einer Hauswand angebracht, reicht für diese Thermometer der Bereich (insbesondere in Europa) vollkommen aus, ebenso die Genauigkeit.
- Nr. 4 Bratenthermometer: Übliche Backöfen können eine Temperatur von ca. 230 °C erreichen. Da eine Messung erst ab einer Temperatur über der Zimmertemperatur Sinn ergibt, reichen Messbereich und Messgenauigkeit hier vollkommen aus.
Gasteilchen bewegen sich schneller, wenn sich das Gas erwärmt. Aufgrund der großen Abstände zwischen den Teilchen ist das in Spraydosen und Gasflaschen erst einmal nicht schlimm, die Teilchen stoßen jedoch häufiger zusammen und gegen die Gefäßwände. Wird die Temperatur zu groß und die Teilchen zu schnell, kann die Spraydose diese Stöße aber nicht mehr aushalten und explodiert.
a) Beim Abkühlen unterhalb von 4 °C und insbesondere beim Übergang von flüssig zu fest benötigen Wasserteilchen (anders als andere Flüssigkeiten) mehr Platz (Anomalie des Wassers). Bietet das Gefäß diesen Platz nicht, werden die Gefäßwände stark auseinandergedrückt. Insbesondere Glasflaschen, aber auch Plastikflaschen platzen dann.
b) Im Allgemeinen verhält sich Wasser beim Abkühlen wie die meisten anderen Flüssigkeiten: das Volumen verkleinert sich und die Dichte nimmt zu. Allerdings weist Wasser zwischen 0 °C und 4 °C eine Ausnahme auf: Es dehnt sich aus – das Volumen nimmt zu und die Dichte wird geringer. Diese Anomalie hat eine direkte Auswirkung auf Wasserlebewesen. Wenn Wasser unter 4 °C abgekühlt wird, bildet sich eine isolierende Schicht aus kälterem Wasser über wärmerem Wasser. Dadurch bietet das Wasser in Bodennähe des Sees Lebensraum
und Schutz für viele Organismen während des Winters.
Die Anomalie führt auch dazu, dass Eis eine geringere Dichte als Wasser hat. Dadurch bildet Eis eine schwimmende Schicht auf Gewässern. Ohne diese Anomalie würde Eis am Boden von Gewässern entstehen, sodass dort kein Überleben im Winter möglich wäre.
Die Anomalie des Wassers ist damit lebensnotwendig für das gesamte Leben auf der Erde, da so Ökosysteme aufrechterhalten werden.
| fest | flüssig | gasförmig |
| Holz | Öl | Luft |
| Plastik | Benzin | Helium |
| Eis | Wasser | Wasserdampf |
Das Föhnen der Haare nach dem Waschen hat im Wesentlichen zwei Funktionen: Zum einen führt es warme Luft zu. Diese erwärmt die Haare und verstärkt die Verdunstung. Zum anderen wird die durch die Verdunstung angefeuchtete Luft abgeführt und trockene Luft zugeführt. Das beschleunigt ebenfalls die Verdunstung des Wassers in den Haaren. Hinzu kommt noch, dass der bewegte Luftstrom die durch die Feuchtigkeit zusammenhängenden Haare voneinander trennt und so die Oberfläche für die Verdunstung erhöht.
a) Das von der Wäsche aufgenommene flüssige Wasser verdunstet, es wird als Wasserdampf in der Umgebungsluft gespeichert.
b) Durch das Duschen erwärmt sich die Luft des Badezimmers. In ihr ist Wasser als Wasserdampf gespeichert. Kommt es mit dem kälteren Spiegel in Kontakt, kondensiert es und es bilden sich kleine Tröpfchen – der Spiegel „beschlägt“.
c) Beim Erreichen der Siedetemperatur geht das flüssige Nudelwasser in den gasförmigen Zustand über – es siedet. Da dies zumeist am heißen Topfboden zuerst passiert, steigt das Gas nach oben und bildet Gasblasen, die an der der Wasseroberfläche zerplatzen – das Nudelwasser „kocht“.
d) Durch das Öffnen des Kühlschranks gelangt warme Luft hinein, in der Wasser als Wasserdampf gespeichert ist. Kommt die Luft mit der kalten Kühlschrankwand in Kontakt, kondensiert der enthaltene Wasserdampf. Es bilden sich Tropfen flüssigen Wassers.
e) Wenn im Winter die Temperaturen sinken, kühlt sich die Luft und nach und nach auch das Wasser im See ab. Erreicht die Wassertemperatur 0 °C, dann beginnt das Wasser zu gefrieren – es bildet sich Eis. Aufgrund der geringeren Dichte von Eis im Gegensatz
zu Wasser bildet sich die Eisschicht an der Oberfläche des Sees.
Die schwarze Metallplatte und das Rohr absorbieren die Wärmestrahlung von der Sonne. Die Wärmedämmung verhindert, dass durch Wärmeleitung Wärme abgegeben wird. Die Glasscheibe verhindert die selbsttätige Wärmeströmung der Luft. Durch Wärmeleitung gelangt die Wärme auf die Innenseite des Rohrs und wird dort an das Wasser abgegeben. Das Wasser transportiert die Wärme durch Wärmeströmung z. B. ins Haus.
Wärmeenergie ist eine Form von Energie. Wärmeenergie wird benötigt, um die Temperatur eines Körpers zu erhöhen.
Der Begriff Wärme beschreibt, wie viel Energie ein Körper thermisch aufnehmen kann.
Gegeben:
Wärmeenergie \(Q = \Delta E = 2245 \, \text{kJ} \)
Temperaturdifferenz \(\Delta T = 50 \, \text{K} \)
spezifische Wärmekapazität \(c_\text{Wasser} = 4,2 \, \frac{\text{kJ}}{\text{kg} \, \cdot \, \text{K}} \) und \(c_\text{Öl} = 1,7 \, \frac{\text{kJ}}{\text{kg} \, \cdot \, \text{K}} \)
Gesucht:
Masse \(m_\text{Wasser} \) und \(m_\text{Öl} \)
Berechnung:
\(Q = c \cdot m \cdot \Delta T \Rightarrow m = \frac{Q}{c \, \cdot \, \Delta T} \)
\(m_\text{Wasser} = \frac{2245 \, \text{kJ} \, \cdot \, \text{kg} \, \cdot \, \text{K}}{4,2 \, \text{kJ} \, \cdot \, 50 \, \text{K}} = 10,7 \, \text{kg} \)
\(m_\text{Öl} = \frac{2245 \, \text{kJ} \, \cdot \, \text{kg} \, \cdot \, \text{K}}{1,7 \, \text{kJ} \, \cdot \, 50 \, \text{K}} = 26,4 \, \text{kg} \)
Ergebnis:
Die Energie einer 100-g-Tafel Schokolade reicht aus, um \(10,7 \, \text{kg} \) Wasser bzw. \(26,4 \, \text{kg} \) Speiseöl um \(50 \, \text{K} \) zu erwärmen.
Die Ursache liegt in der unterschiedlichen spezifischen Wärmekapazität von Wasser und von Gestein. Wasser hat eine sehr hohe spezifische Wärmekapazität, d. h., im Frühling und Sommer kann das Wasser viel Wärme speichern, die dann im Herbst und im Winter langsam wieder abgeben wird. Dadurch sind die Temperaturen an Küsten und an großen Seen milder.
Im Landesinneren tritt genau der gegenteilige Effekt auf. Die geringe spezifische Wärmekapazität von Gestein sorgt dafür, dass weniger Wärme im Frühling und Sommer aufgenommen wird. Im Herbst und im Winter kann daher auch weniger Wärme wieder an die Umgebung abgegeben werden. Es ist kühler.
a)
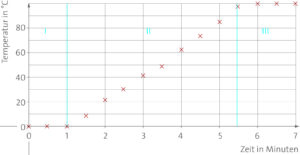
© Cornelsen/newVISION! GmbH, Bernhard A. Peter
Das Diagramm zeigt, dass die Temperatur nicht dauerhaft steigt. Zunächst bleibt sie bei 0 °C und steigt dann an, bis sie nach etwa 6 Minuten bei 100 °C liegt. Danach bleibt sie wieder konstant.
b) Siehe Teilaufgabe a.
c) In Phase I wird dem Eis Energie zugeführt. Diese Energie wird genutzt, um den Zusammenhalt der Teilchen untereinander aufzubrechen. Daher erhöht sich die Temperatur nicht. Erst, wenn das gesamte Eis geschmolzen ist, steigt die Temperatur, d. h., die Wärmeenergie wird größer (Phase II). Bei 100 °C geht das Wasser in Wasserdampf über, es verdampft. Auch hier wird die Energie wieder genutzt, um den Zusammenhalt der Teilchen aufzubrechen, sodass die Temperatur konstant bleibt.
a) Die Energie zum Schmelzen der Eiswürfel wird dem Orangensaft entzogen.
b) Gegeben:
Menge des Orangensafts: \(300 \, \text{cm}^3 \approx 0,3 \, \text{kg} \)
Energie zum Schmelzen \(Q = \Delta E = 16,7 \, \text{kJ} \)
spezifische Wärmekapazität \(c_\text{Wasser} = 4,2 \, \frac{\text{kJ}}{\text{kg} \, \cdot \, \text{K}} \)
Gesucht:
Endtemperatur des Saft \(\Delta T \)
Berechnung:
\(Q = c \cdot m \cdot \Delta T \Rightarrow \Delta T = \frac{Q}{c \, \cdot \, m} \)
\(\Delta T = \frac{16,7 \, \text{kJ} \, \cdot \, \text{kg} \, \cdot \, \text{K}}{4,2 \, \text{kJ} \, \cdot \, 0,3 \, \text{kg}} = 13,3 \, \text{K} \)
Ergebnis:
Die Temperatur des Safts nimmt um \(13,3 \, \text{K} \) ab, d. h., der Saft hat noch eine Temperatur von \(16,7 \, \text{°C} \).