Kohlenstoff – der Molekülbauer: Vorbereitung
Sieh dir die Übersicht an. Sie hilft dir, die Aufgaben zu beantworten.
Verbrennungen
Verbrennungen sind Reaktionen der Brennstoffe mit Sauerstoff. Brennstoffe wie Holz, Kohle, Öl und Gas enthalten das Element Kohlenstoff. Kohlenstoff reagiert mit dem Sauerstoff der Luft zu Kohlenstoffdioxid. Aus den Ausgangsstoffen wie Holz
und Sauerstoff entstehen bei diesem Verbrennungsvorgang Kohlenstoffdioxid und Wasser.
Reaktionsgleichungen
Um chemische Reaktionen übersichtlich zu notieren, benutzt man Reaktionsgleichungen.
Ausgangsstoff A + Ausgangsstoff B → Reaktionsprodukt AB
Beispiel:
Eisen + Sauerstoff → Eisenoxid
Chemische Reaktionen werden folgendermaßen gelesen:
Eisen reagiert mit Sauerstoff zu Eisenoxid.
Die Ausgangsstoffe einer Reaktion werden als Edukte bezeichnet. Die entstehenden Stoffe nennt man Produkte.
Elektronenpaarbindung
Alle Atome streben den Edelgaszustand an. Dabei ist die äußerste Schale voll mit Elektronen besetzt. Lediglich bei den Atomen der VIII. Hauptgruppe, den Edelgasen, ist dieser Zustand gegeben.
„Fehlt“ ein Elektron, damit die äußerste Schale voll ist, so gehen Atome eine Elektronenpaarbindung ein. Dabei teilen sich zwei Atome ein Elektronenpaar, welches sich dann im gemeinsamen Bereich beider Atomhüllen befindet.
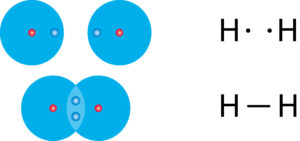
Das gemeinsame negativ geladene Elektronenpaar zieht jeweils die beiden positiv geladenen Atomkerne an. Dadurch bleiben die Atome miteinander verbunden.
Fehlen zwei Elektronen zum Edelgaszustand, wie z. B. beim Sauerstoff-Atom, so gehen diese Atome auch zwei Elektronenpaarbindungen ein. Bestehen diese beiden Bindungen zu einem Partner-Atom, so spricht man von einer doppelten Elektronenpaarbindung.
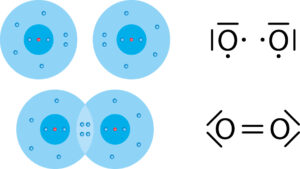
Ein Atom kann bis zu vier solcher Elektronenpaarbindungen eingehen – entweder mit verschiedenen „Partnern“ oder auch eine Doppel- oder Dreifachbindung mit einem „Partner“.
Elektronegativität
Alle Atome ziehen aufgrund ihres positiv geladenen Atomkerns das Bindungselektronenpaar an sich. Diese Eigenschaft bezeichnet man als Elektronegativität (abgekürzt EN). Die Elektronegativität ist bei den Atomen jedoch unterschiedlich stark.
Gehen zwei Atome mit unterschiedlicher Elektronegativität eine Elektronenpaarbindung ein, so hält sich das gemeinsame Bindungselektronenpaar näher bei dem Atom auf, welches die höhere Elektronegativität aufweist.
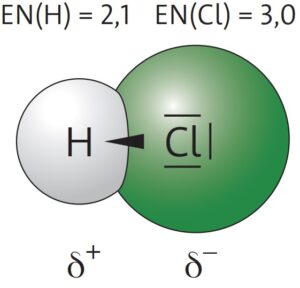
Am Beispiel der Elektronenpaarbindung im Chlorwasserstoffmolekül (HCl) erkennt man, dass die Bindungselektronen näher zum Chlor hin verschoben sind. Durch diese Verschiebung bildet sich beim Chlor-Atom eine negative Teilladung δ–
(gesprochen: Delta minus) aus. Am Wasserstoff-Atom bildet sich entsprechend eine positive Teilladung δ+ aus. Aufgrund der beiden Pole (δ– und δ+) spricht man von einer polaren Elektronenpaarbindung. Besitzt ein Molekül zwei Pole und die Ladungsschwerpunkte liegen auseinander, so spricht man von einem Dipol.
Destillation
Beim technischen Verfahren der Destillation von Rotwein zu Brandwein nutzt man die unterschiedlichen Siedetemperaturen von Alkohol und Wasser. Dabei kommt es zu einem stufenweisen Verdampfen und Kondensieren der verschiedenen Flüssigkeiten. Der Kondensationsvorgang wird durch eine Wasserkühlung verstärkt. Das flüssige Destillat wird anschließend aufgefangen.
Kannst du jetzt die Aufgaben lösen? Probiere es aus
Illustrationen: Cornelsen/Detlef Seidensticker Bewegtes Bild: Cornelsen/Rainer Götze