Elektrische Energie und chemische Prozesse: Vorbereitung
Sieh dir die Übersicht an. Sie hilft dir, die Aufgaben zu beantworten.
Chemische Reaktionen
Erklärvideo: Chemische Reaktionen kurz erklärt (mit Ton)
Kennzeichen einer chemischen Reaktion
Bei chemischen Reaktionen entstehen aus den Ausgangsstoffen (Edukten) neue Stoffe, die Reaktionsprodukte. Es findet also eine Stoffumwandlung statt. Sie ist ein Kennzeichen chemischer Reaktionen. Dabei kann man zum Beispiel ein Aufglühen, einen Farbumschlag oder eine Gasentwicklung beobachten.
Weitere Kennzeichen chemischer Reaktionen sind der Energieumsatz und das Gesetz der Massenerhaltung.
Reaktionsgleichungen
Um chemische Reaktionen übersichtlich zu notieren, benutzt man Reaktionsgleichungen.
Ausgangsstoff A + Ausgangsstoff B → Reaktionsprodukt AB
Beispiel:
Eisen + Sauerstoff → Eisenoxid
Chemische Reaktionen werden folgendermaßen gelesen:
Eisen reagiert mit Sauerstoff zu Eisenoxid.
Die Ausgangsstoffe einer Reaktion werden als Edukte bezeichnet. Die entstehenden Stoffe nennt man Produkte.
Oxidation und Reduktion
Nimmt ein Stoff bei einer chemischen Reaktion Sauerstoff auf, so spricht man von einer Oxidation.
Eine Reduktion liegt dagegen vor, wenn ein Stoff bei einer chemischen Reaktion Sauerstoff abgibt.
Da Oxidation und Reduktion stets gekoppelt ablaufen, spricht man auch von einer Reduktions-Oxidations-Reaktion, kurz Redoxreaktion.
Beispiel:
Reduktion: Kupferoxid → Kupfer + Sauerstoff
Oxidation: Kohlenstoff + Sauerstoff → Kohlenstoffdioxid
Redoxreaktion: Kupferoxid + Kohlenstoff → Kupfer + Kohlenstoffdioxid
Kupferoxid gibt Sauerstoff ab, es wird bei der Reaktion reduziert.
Kohlenstoff nimmt Sauerstoff auf, er wird bei der Reaktion oxidiert.
Ionen
Atome streben immer den Edelgaszustand an.
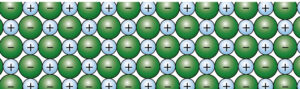
Atome, die Elektronen aufnehmen bzw. abgeben und folglich geladen sind, nennt man Ionen.
Ionen können positiv oder negativ geladen sein. Die positiv geladenen Ionen heißen Kationen, die negativ geladenen Ionen Anionen.
In der Formelschreibweise werden die Ladungen der Ionen als Hochzahl rechts neben dem Elementsymbol angegeben.
Die positiv und negativ geladenen Ionen ziehen sich gegenseitig an. Die entstehende Bindung wird Ionenbindung genannt.
Viele positiv und negativ geladene Ionen lagern sich dabei regelmäßig zusammen: Es entsteht ein Ionengitter. Salzkristalle sind aus solchen Ionengittern aufgebaut.
Kannst du jetzt die Aufgaben lösen? Probiere es aus.
Illustration: Cornelsen/Detlef Seidensticker