Vielfalt der Salze: Vorbereitung
Sieh dir die Übersicht an. Sie hilft dir, die Aufgaben zu beantworten.
Schmelz- und Siedetemperatur
Die Schmelztemperatur ist die Temperatur, bei der ein Stoff vom festen in den flüssigen Zustand übergeht.
Die Siedetemperatur ist die Temperatur, bei der ein Stoff vom flüssigen in den gasförmigen Zustand übergeht.
Schmelz- und Siedetemperatur hängen von der Art des Stoffs ab.
– Wenn das Eis erwärmt wird, dann erreicht es bei 0 °C seine Schmelztemperatur. Es wird flüssig.
– Wenn man das flüssige Wasser weiter erwärmt, erreicht es seine Siedetemperatur von 100 °C. Das Wasser verdampft nun und wird gasförmig.
Löslichkeit
Feststoffe, Gase und Flüssigkeiten können sich in einer Flüssigkeit dem sogenannten Lösungsmittel lösen. Lösungsmittel sind Flüssigkeiten, die andere Stoffe feinst möglich in sich verteilen. Es handelt sich nicht immer um Wasser. Stoffe können in einem Lösungsmittel leicht oder schwer löslich sein. Die Löslichkeit wird durch die Temperatur des
Lösungsmittels beeinflusst.
Ist die maximale Menge eines Stoffes in einem Lösungsmittel gelöst, spricht man von einer gesättigten Lösung.
Ist die Grenze der Löslichkeit von z. B. Salz in Wasser erreicht, bildet sich ein Bodensatz.
Dipole
Wasser ist eine Verbindung bestehend aus zwei Atomen Wasserstoff und einem Atom Sauerstoff. Aufgrund der unterschiedlichen Elektronegativitäten von Wasserstoff und Sauerstoff werden die Bindungselektronen unterschiedlich stark zu den Atomen hingezogen. Das Sauerstoff-Atom zieht die Bindungselektronen stärker an.
Dies führt zu einer Ladungsverschiebung innerhalb des Moleküls. Beim Sauerstoff-Atom bildet sich eine negative Teilladung, bei den Wasserstoff-Atomen eine positive Teilladung.
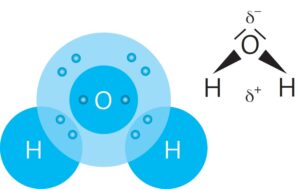
Durch den gewinkelten Bau des Wassermoleküls führen seine Teilladungen dazu, dass das gesamte Molekül zwei Pole hat: Man nennt es daher ein Dipolmolekül oder sagt auch: Die Bindungen im Wassermolekül und das ganze Molekül sind polar.
Moleküle, die verschiedene Pole ausbilden werden als Dipole bezeichnet.
Kannst du jetzt die Aufgaben lösen? Probiere es aus.
Illustration: Cornelsen/Detlef Seidensticker