Wasser – genau untersucht: Vorbereitung
Sieh dir die Übersicht an. Sie hilft dir, die Aufgaben zu beantworten.
Trennverfahren
Stoffgemische lassen sich durch unterschiedliche Verfahren in ihre Bestandteile trennen. Diese Trennverfahren nutzen die Eigenschaften der Stoffe wie Dichte, Löslichkeit oder Siedetemperaturen.
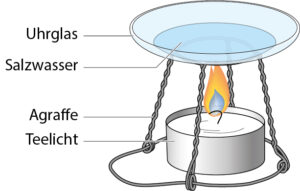
Eindampfen • Lösungen aus Flüssigkeiten und Feststoffen, z. B. Salzwasser, können nur durch Eindampfen getrennt werden.
Der gelöste Feststoff Salz wird abgetrennt, indem man das Wasser verdampfen lässt. Wasser hat eine viel niedrigere Siedetemperatur als Salz.
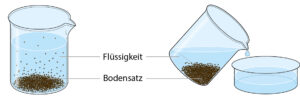
Sedimentieren und Dekantieren • Stoffgemische aus Flüssigkeiten und groben Feststoffen kannst du trennen, indem
du das Gemisch einfach stehen lässt. Die Feststoffe setzen sich auf dem Boden des Gefäßes ab. Diesen Bodensatz nennt man Sediment und den Vorgang Sedimentieren. → 3 Dann gießt du die überstehende Flüssigkeit einfach ab. Man sagt auch: Man dekantiert die Flüssigkeit.
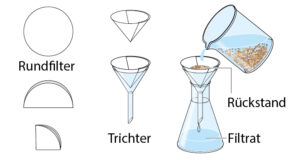
Filtrieren • Gemische aus Flüssigkeiten und feineren Feststoffen werden mithilfe eines Filters voneinander getrennt. Dazu
faltest du einen Rundfilter zu einem Viertelkreis und platzierst ihn dann in einem Trichter. Anschließend gibst du das Stoffgemisch in den Trichter. Die Feststoffe bleiben als Rückstand im Filter, die Flüssigkeit fließt durch den Filter und landet als Filtrat im Auffanggefäß.
Reinstoff, Stoffgemisch, Element, Verbindung
Kann man eine Stoffprobe durch Trennverfahren wie zum Beispiel Filtrieren oder Eindampfen trennen, so hat man ein Stoffgemisch vorliegen.
Gibt es kein Trennverfahren, mit dem man eine Stoffprobe trennen kann, so handelt es sich um einen Reinstoff.
Einen Reinstoff, der aus mindestens zwei verschiedenen Atomsorten besteht, die miteinander verbunden sind, nennt man eine Verbindung.
Reinstoffe, die nur aus einer Atomsorte bestehen, nennt man Elemente.
Nachweisreaktionen
Mit einer Nachweisreaktion kann man feststellen, ob ein bestimmter Stoff in einem Stoffgemisch vorhanden ist. Der Stoff ist aufgrund einer nur für ihn charakteristischen Eigenschaft nachweisbar.
Nachweis von Sauerstoff • Sauerstoff ist für eine Verbrennung notwendig. Stoffe verbrennen in reinem Sauerstoff besser als in Luft. Diese Beobachtung nutzt man, um reinen Sauerstoff nachzuweisen.
Ein Holzspan, der nur glimmt, flammt in reinem Sauerstoff auf. Dies bezeichnet man als Glimmspanprobe.
Nachweis von Kohlenstoffdioxid • Das Gas Kohlenstoffdioxid weist man durch Einleiten in Kalkwasser nach. Kalkwasser ist eine gesättigte Kalklösung. Leitet man Kohlenstoffdioxid in Kalkwasser ein, entsteht eine milchig-trübe Flüssigkeit und es bildet sich ein weißer Feststoff: Kalk. Dies bezeichnet man als Kalkwasserprobe.
Nachweis von Wasser • Wasser kann man nachweisen, wenn man es mit dem Stoff Kupfersulfat in Kontakt bringt. Wasserfreies Kupfersulfat ist ein weißes Pulver. Bei Kontakt mit dem Wasser in der Luft färbt sich Kupfersulfat blau. Chemiker verwenden Watesmopapier, um Wasser nachzuweisen. Dieses enthält Kupfersulfat und färbt sich bei der Anwesenheit von Wasser dunkelblau.
Reaktionsgleichungen
Um chemische Reaktionen übersichtlich zu notieren, benutzt man Reaktionsgleichungen.
Ausgangsstoff A + Ausgangsstoff B → Reaktionsprodukt AB
Beispiel:
Eisen + Sauerstoff → Eisenoxid
Chemische Reaktionen werden folgendermaßen gelesen:
Eisen reagiert mit Sauerstoff zu Eisenoxid.
Die Ausgangsstoffe einer Reaktion werden als Edukte bezeichnet. Die entstehenden Stoffe nennt man Produkte.
Chemische Reaktionen und Energie
Bei chemischen Reaktionen wird immer Energie umgewandelt. Wird im Laufe der Reaktion Energie freigesetzt, so nennt man diese Reaktion exotherm.
Im Gegensatz dazu nennt man eine Reaktion, bei der fortlaufend Energie zugeführt werden muss, eine endotherme Reaktion.
Einige exotherme Reaktionen, laufen nicht von alleine an. Es muss zunächst etwas Energie zugeführt werden, um die Reaktion in Gang zu bringen. Diese notwendige Energiemenge nennt man Aktivierungsenergie.
Elektronenpaarbindung
Alle Atome streben den Edelgaszustand an. Dabei ist die äußerste Schale voll mit Elektronen besetzt. Lediglich bei den Atomen der VIII. Hauptgruppe, den Edelgasen ist dieser Zustand gegeben.
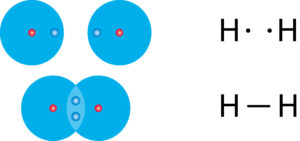
„Fehlt“ ein Elektron, damit die äußerste Schale voll ist, so gehen Atome eine Elektronenpaarbindung ein. Dabei teilen sich zwei Atome ein Elektronenpaar, welches sich dann im gemeinsamen Bereich beider Atomhüllen befindet.
Bewegtes Bild: Cornelsen/Rainer Götze
Das gemeinsame negativ geladene Elektronenpaar zieht jeweils die beiden positiv geladenen Atomkerne an. Da durch bleiben die Atome miteinander verbunden.
Fehlen zwei Elektronen zum Edelgaszustand, wie z. B. beim Sauerstoff-Atom, so gehen diese Atome auch zwei Elektronenpaarbindungen ein. Bestehen diese beiden Bindungen zu einem Partner-Atom, so spricht man von einer doppelten Elektronenpaarbindung.
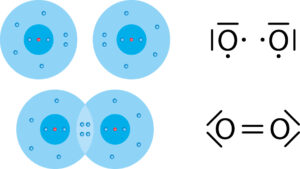
Ein Atom kann bis zu vier solcher Elektronenpaarbindungen eingehen – entweder mit verschiedenen „Partnern“ oder auch eine Doppel- oder Dreifachbindung mit einem „Partner“.
Kannst du jetzt die Aufgaben lösen? Probiere es aus.