Drei Wege zum Edelgaszustand: Vorbereitung
Sieh dir die Übersicht an. Sie hilft dir, die Aufgaben zu beantworten.
Die Atomhülle
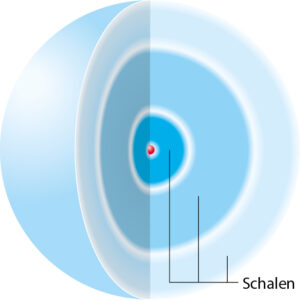
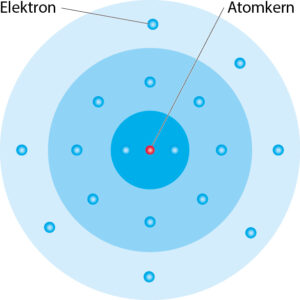
Gruppen von Elektronen, die sich auf einem ähnlichen Energieniveau befinden, bilden gemeinsam eine Elektronenschale. Diese „Schalen“ umgeben den Atomkern kugelförmig. Dabei sind die darin enthaltenen Elektronen nicht an einem festen Ort, sondern bewegen sich ständig um den Atomkern. Dieses Atommodell nennt man daher „Schalenmodell“.
Die verschiedenen Schalen können unterschiedlich viele Elektronen aufnehmen. So kann die innerste Schale nur mit 2 Elektronen besetzt werden. Die 2. Schale kann 8 und die 3. bis zu 18 Elektronen auf nehmen. Für die Besetzung der äußersten Schale gilt, dass sie immer nur mit bis zu 8 Elektronen besetzt werden kann. Eine Ausnahme von dieser Regel bildet die Besetzung der 1. Schale. Diese hat nur Platz für 2 Elektronen.
Die Elektronen auf der äußersten Schale bezeichnet man als Außenelektronen. Ihre Anzahl ist für die chemischen Eigenschaften des Stoffs verantwortlich, aus dem die Atome aufgebaut sind.
Der Edelgaszustand
Edelgase haben eine voll besetzte äußerste Elektronenschale. Dies wird als Edelgaszustand bezeichnet, der von allen Atomen angestrebt wird.
Die äußerste Schale ist immer dann voll besetzt, wenn sie 8 Elektronen enthält. Es sei denn es gibt nur die 1. Schale. Diese gilt mit 2 Elektronen als voll besetzt.
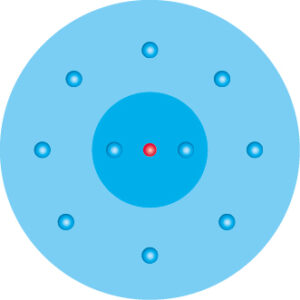
Aufgrund ihrer voll besetzten äußersten Elektronenschale sind die Edelgase sehr reaktionsträge.
Besonders reaktionsfreudig sind dagegen die Alkalimetalle, Erdalkalimetalle und die Halogene. Ihre Atome besitzen nicht vollbesetze äußerste Elektronenschalen.
Das Periodensystem
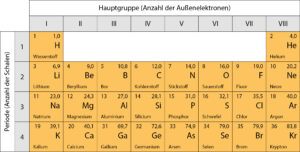
Das Periodensystem der
Elemente (PSE) vereint mehrere Ordnungsmerkmale:
- Alle Elemente im Periodensystem sind nach steigender Ordnungszahl angeordnet. Die Ordnungszahl entspricht der Anzahl der
Protonen bzw. der Elektronen. Liest man das Periodensystem wie einen Text von links oben nach rechts unten,
so steigt die Ordnungszahl und damit die Anzahl der Protonen und Elektronen in den Atomen um jeweils eins an. - Elemente, die untereinander stehen, haben gleich viele Außenelektronen. Solche Elemente bilden eine Hauptgruppe. Elemente einer Hauptgruppe haben häufig ähnliche Eigenschaften.
- Elemente, die in einer Zeile stehen, haben gleich viele Schalen. Die Zeilen nennt man auch Perioden.
Kannst du jetzt die Aufgaben lösen? Probiere es aus.
Illustrationen: Cornelsen/Detlef Seidensticker Bewegtes Bild: Cornelsen/Rainer Götze